下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
| 原子半径(10-10m) |
1.52 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
0.71 |
| 最高价态 |
+1 |
+1 |
/ |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
/ |
| 最低价态 |
/ |
/ |
-2 |
/ |
-4 |
-3 |
-1 |
/ |
-3 |
-1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式) 。某元素R的原子半径为1. 02×10-10m,该元素在周期表中位于 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
02×10-10m,该元素在周期表中位于 ;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式 。
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
(1)在 H、
H、 H、
H、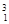 H、
H、 Mg、
Mg、 Mg和
Mg和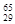 Cu中共有______种元素,______种原子。
Cu中共有______种元素,______种原子。
(2) 射线是由粒子组成的,粒子是一种没有核外电子的粒子,它带有2个单位正电荷,它的质量数等于4,由此推断粒子带有_________个中子。
有下列各组物质:
A.Al(OH)3与H3AlO3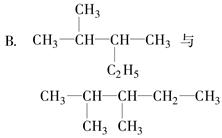
C.金刚石与石墨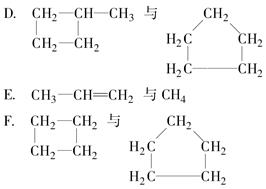
(1)互为同素异形体的是________。
(2)属于同系物的是________。
(3)互为同分异构体的是________。
(4)属于同一物质的是________。
人们对苯的认识有一个不断深化的过程。
(1)写苯与H2发生加成反应的化学方程式_________________________________________。
(2)烷烃中脱去2 mol氢原子形成1 mol双键要吸热,但1,3-环己二烯(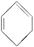 )脱去2 mol氢原子变成苯却放热,可推断苯比1,3-环己二烯__________(填“稳定”或“不稳定”)。
)脱去2 mol氢原子变成苯却放热,可推断苯比1,3-环己二烯__________(填“稳定”或“不稳定”)。
(3)1866年凯库勒提出了苯是单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解决下列________事实(填入编号)。
| A.苯不能使溴水褪色 | B.苯能与H2发生加成反应 |
| C.溴苯没有同分异构体 | D.邻二溴苯只有一种 |
(4)现代化学认为苯分子碳碳之间的键是______。
写出下列变化的化学方程式,并注明反应条件和反应类型。
(1)乙烯和氯化氢__________________________________________;
(2)苯和浓硝酸__________________________________________;
(3)苯和溴_________________________________________。
(8分)给你提供纯锌、纯铜片和500mL0.2mol·L-1的H2SO4溶液、导线、1000mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
(1)如图所示,装置气密性良好,且1000mL量筒中已充满了水,则开始实验时,首先要______________________________________。
(2)a电极材料为__________,其电极反应式为______________________。
b电极材料为__________,其电极反应式为__________________。
(3)当量筒中收集到672mL气体时(已折算到标准状况下),通过导线的电子的物质的量为________。