用NA表示阿佛加德罗常数,下列说法正确的是
| A.22.4L H2的物质的量约为1mol |
| B.标准状况下,11.2L H2O的物质的量约为1 mol |
| C.1 L 1mol/L的MgCl2溶液中Cl-的物质的量浓度为 2mol/L |
| D.0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.3NA |
下列有关说法正确的是
| A.4CuO(s)=2Cu2O(s)-+O2(g)在室温下不能自发进行,说明该反应△H<0 |
| B.生铁和纯铁同时放入海水中,纯铁更易腐蚀 |
| C.常温下,PbSO4易溶于pH=7的CH3COONH4溶液,说明((CH3COO)2Pb是弱电解质 |
D.H2S(g)+FeO(s)  FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大 FeS(s)+H2O(g),其他条件不变时增大压强,反应速v(H2S)和H2S的平衡转化率均增大 |
下列表示对应化学反应的离子方程式正确的是
| A.足量Cl2通入FeBr2溶液中:Br-+ Cl2 = Br2 +2Cl- |
| B.用NaClO除去水体中CO(NH2)2产生CO2和N2:3ClO +CO(NH2)2=3Cl- +CO2↑+N2↑+2H2O |
| C.过量CO2通入Na2SiO3溶液中:Si032-+CO2+H2O = H2SiO3↓+CO32- |
| D.Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2+ +HCO3-+OH-= CaCO3↓+H2O |
设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.45gHCHO与CH3COOH混合物含氢原子数为3NA |
| B.常温常压下,54g重水(D2O)含水分子数为3NA |
| C.标准状况下,11.2L苯含有C-H键数目为3NA |
| D.反应KIO3+6HI=3I2+KI+3H2O,每生成1.5mol I2转移电子数为3NA |
下列是部分矿物资源的利用及产品流程(如图),有关说法不平确的是
| A.粗铜电解精炼时,粗铜作阳极 |
| B.生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应 |
| C.黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料 |
| D.粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法 |
下列使用漏斗的几个实验装置中,设计正确且能达到实验目的的是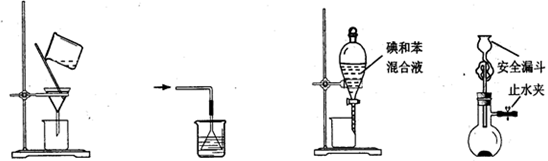
图1图2图3图4
| A.用图1所示装置进行过滤,过滤时不断搅拌 |
| B.用图2所示装置吸收NH3制氨水 |
| C.用图3所示装置用苯萃取碘水中的碘,并把碘的苯溶液从漏斗下口放出 |
| D.用图4所示装置用石灰石与稀盐酸制取CO2气体 |