在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是
| A.Na2O | B.Na2O2 | C.Na2O和Na2O2 | D.Na2O2和Na |
下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4②碱性:Ba(OH)2>Mg(OH)2>Be(OH)2
③氧化性:F>C>O④氧化性:Li+﹤Na+﹤K+
⑤气态氢化物稳定性:HF>HCl>H2S
| A.①②③ | B.①②④⑤ | C.②③④ | D.①②⑤ |
关于下图所示装置的叙述,错误的是()
| A.锌是负极,其质量逐渐减小 |
| B.氢离子在铜表面被还原,产生气泡 |
| C.电流从锌片经导线流向铜片 |
| D.电子从锌片经导线流向铜片 |
C、CO、CH4、C2H5OH是常用的燃料,它们每1 mol分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5 kJ、110.5 kJ、890.3 kJ、1 366.8 kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是()。
A、C B、CO C、CH4D、C2H5OH
工业制硫酸中的一步重要反应是SO2在400~600 ℃下的催化氧化:2SO2+O2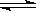 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是()
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是()
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,SO2不可能100%地转化为SO3 |
| C.为了提高SO2的转化率,应适当提高O2的浓度 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
氢氧燃料电池已用于航天飞机。以30% KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH--4e-=4H2OO2+2H2O+4e-=4OH-
据此作出判断,下列说法中错误的是()
| A.H2在负极发生氧化反应 |
| B.供电时的总反应为:2H2+O2=2H2O |
| C.产物为无污染的水,属于环境友好电池 |
| D.燃料电池的能量转化率可达100% |