运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2 (g)+3H2(g) 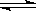 2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平恒体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂 反应的△H(填“增大” “减小” 或“不改变”)。
(2)已知:O2 (g)=O2+(g)+e- 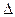 H1=" 1175.7" kJ·mol-1
H1=" 1175.7" kJ·mol-1
PtF6(g)+ e-==PtF6-(g) 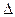 H2=" —771.1" kJ·mol-1
H2=" —771.1" kJ·mol-1
O2+PtF6-(S)=O2+ (g)+ PtF6-(g) 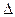 H3=" 482.2" kJ·mol-1
H3=" 482.2" kJ·mol-1
则反应O2(g)+ PtF6(g)= O2+PtF6-(S) 的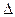 H= kJ·mol-1。
H= kJ·mol-1。
(3)在25℃下,向浓度均 为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP [Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-)。则溶液显 性(填“酸”“碱”或“中”);用含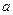 的代数式表示NH3·H2O的电离常数Kb= 。
的代数式表示NH3·H2O的电离常数Kb= 。
溶液中的化学反应大多是离子反应。根据要求回答下列问题。
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:
盐碱地产生碱性的原因:_______________;
(2)已知水存在如下平衡:H2O+H2O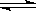 H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”、“<”或“=”)n。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=______。
(5)在下图中画出用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 mol·L-1盐酸的滴定曲线示意图。
按要求填空
(一)现有如下各化合物:①酒精,②氯化铵,③氢氧化钡,④氨水,⑤蔗糖,⑥高氯酸,⑦氢硫酸,⑧硫酸氢钾,⑨磷酸,⑩硫酸。
请用以上物质的序号填写下列空白。
(1)属于电解质的有_______________。
(2)属于强电解质的有_____________。
(3)属于弱电解质的有_________ _ __。
(二)一定温度下有:a.盐酸 b.硫酸c.醋酸三种酸。
(1)当其物质的量浓度相同时,c(H+)由大到小的顺序是___________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH能力的顺序是_________.
(3)当c(H+)相同、体积相同时,同时加入锌,若产生相同体积的H2(相同状况),则开始时的反应速率_______,反应所需时间________。
(4)将c(H+)相同的三种酸均稀释10倍后,c(H+)由大到小的顺序是_______。
向2 L密闭容器中通入6 mol气体A和6 mol气体B,在一定条件下发生反应:xA(g)+yB(g) pC(g)+qD(g) 已知:平均反应速率v(C)=1/2v(A);反应2 min时,A的浓度减少了1mol/L,B的物质的量减少了3mol,有6mol D生成.回答下列问题:
pC(g)+qD(g) 已知:平均反应速率v(C)=1/2v(A);反应2 min时,A的浓度减少了1mol/L,B的物质的量减少了3mol,有6mol D生成.回答下列问题:
(1)反应2min内,v(A)=______,v(B)=______;
(2)该反应化学方程式中x:y:p:q=______;
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2,合并K1,若所盛溶液为CuSO4溶液:则A 极,A极的电极反应式为 .若所盛溶液为KCl溶液:则B极的电极反应式为 .
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);总反应化学方程式是 .
(3)如果要用电解的方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”)。
在如图中,甲烧杯中盛有100 mL 0.50 mol/L AgNO3 溶液,乙烧杯中盛有100 mL 0.25 mol/L CuCl2溶液,A、B、C、D均为 质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g。
(1)电源E为________极
(2)A极的电极反应式为______________,析出物质______ mol。
(3)B极的电极反应式为______________,析出气体______ mL(标准状况)。
(4)D极的电极反应式为______________,析出气体______ mL(标准状况)。
(5)甲烧杯中滴入石蕊试液,________极附近变红,如果继续电离,在甲烧杯中最终得到______溶液。