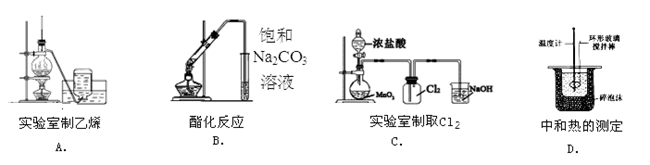NA为阿伏加德罗常数,下列叙述中正确的是
| A.0.1 mol PCl3中形成共价键的电子数是0.3NA |
| B.100 mL 1 mol/L NaHSO4溶液中HSO4—数是0.1NA |
| C.标准状况下,11.2 L CO2和O3混合气体中含有的原子数是1.5 NA |
| D.17 g H2O2完全分解,转移电子数是1NA |
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3-离子中的两种组成,可以发生如图转化,下列说法不正确的是
| A.在甲中滴加丁可能发生反应的离子方程式:HCO3-+ Ba2++OH-= BaCO3↓+ H2O |
| B.溶液丙中还可以大量共存的离子有:I-、NO3-、SO42- |
| C.白色沉淀A可能溶解在溶液D中 |
| D.甲为NaHCO3,乙为AlCl3 |
在两个容积均为1L密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如下图所示。
C2H4(g)+4H2O(g) ΔH。CO2的平衡转化率α(CO2)与温度的关系如下图所示。
下列说法正确的是
| A.该反应的ΔH>0 |
| B.氢碳比:X<2.0 |
| C.在氢碳比为2.0时,Q点v(逆)小于P点的v(逆) |
| D.P点温度下,反应的平衡常数为512 |
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+ H2O  H2SO3 + OH- ①
H2SO3 + OH- ①
HSO3- H+ + SO32- ②
H+ + SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
| A.加入少量固体NaOH,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 |
| B.加入等体积等浓度Na2SO3溶液,则3c(Na+) = 2[c(HSO3-) + c(H2SO3) +c(SO32-)] |
C.加入少量NaOH溶液, 、 、 的值均增大 的值均增大 |
| D.加入氨水至中性,则2c(Na+) = c(SO32-)>c(H+) = c(OH-) |
25℃时,用0.1mol/L的CH3COOH溶液滴定20mL0.1 mol/L的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确的是
A.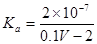 |
B.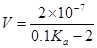 |
C. |
D.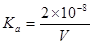 |
下列实验装置正确的是