| |
|
|
|||||||||||||||
| |
|
|
|
|
|
|
|
|
|||||||||
| |
|
|
|
|
|
|
|
||||||||||
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
( 1)在上面元素周期表中画出金属元素与非金属元素的分界线。
1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可把氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族。
(3)甲、乙两种元素,甲元素原子核外第三电子层上有7个电子,乙元素的焰色反应呈黄色。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲元素与硫元素相比较,非金属性较强的是 (填名称),写出可以验证该结论的一个化学方程式: 。
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
(1) 贝诺酯分子式为
(2) 对乙酰氨基酚在空气易变质,原因是 。
(3) 用浓溴水区别乙酰水杨酸和对乙酰氨基酚,方案是否可行 (填“可行”或“不可行”)。
(4)写出乙酰水杨酸与足量氢氧化钠溶液反应的化学方程式 。
(5)实验室可通过两步反应,实现由乙酰水杨酸制备 ,请写出两步反应中依次所加试剂的化学式 、 。
,请写出两步反应中依次所加试剂的化学式 、 。
下图为某有机物的质谱图,测得其含碳量为76.6%,含氢量为6.4%,其余为氧元素。
(1)该有机物的分子式为_____________________________;
(2)往该有机物溶液中滴入FeCl3溶液,可以看到溶液呈紫色,可以确定该有机物的结构简式为_______;
(3)该有机物与浓溴水反应的方程式为_______________________________;
(4)往该有机物的水溶液一般呈白色浑浊状,往溶液中滴入NaOH溶液,现象是______________,反应方程式为_______________________。
在北方,常用乙二醇作内燃机的抗冻剂。某种合成乙二醇的路径如下图所示: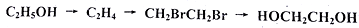
(1)按先后顺序,依次完成上图中每步反应的化学方程式:
①_______________________________________
②_______________________________________
③_______________________________________
(2)一定条件下,乙二醇可以被氧化为乙二醛,反应方程式为:______________________________
(3)CH2BrCH2Br有一同分异构体,其结构简式为:______________________________
家庭使用的天然气主要成分是甲烷,液化石油气的主要成分为丙烷。
(1)将等物质的量的甲烷和氯气混合后,在漫射光的照射下充分反应,所得产物中物质的量最大的是________(写化学式,下同),在所有生成物中,和甲烷分子一样具有正四面体结构的物质是___________;
(2)液化石油气燃烧的主要化学方程式为__________________________;现有一套以天然气为原料的灶具,欲改为烧液化石油气,需要对灶具进行改装的措施是:_______________空气进量(填“增大”或“减小”);
(3)丙烷可以认为是丙烯的加成产物,也可以认为是某块的加成产物,该炔是_________(写结构简式);
(4)丙烯跟溴起加成反应,标准状况下,11.2L丙烯可以与________gBr2完全反应。
(1)请用系统命名法给下列有机物予以命名:
① ______________________
______________________
② ________________________
________________________
(2)请写出下列化合物的结构简式:
①3-乙基-2-戊醇 _______________________________