将10g铁粉置于40mL较浓的硝酸中,微热完全反应时,收集到NO2和NO混合气体1792mL(标准状况下),还残留4.4g固体。求:
(1)该反应中被还原的硝酸和未被还原的硝酸的物质的量之比;
(2)原硝酸的物质的量浓度;
(3)NO和NO2的体积比;
(4)写出总的化学方程式。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气体,通过计算推断它的分子式。
(3)若原气体是两种等物质的量的气体的混合物,其中只有一种是烃,请写出它们的分子式(只要求写出一组)。
合成氨工厂常通过测定反应前后混合气体的密度来确定氮的转化率。某工厂测得合成塔中N2、H2混合气体的密度为0.5536g/L(标准状况),从合成塔中出来的混合气体在相同条件下密度为0.693g/L(标准状况)。求该合成氨厂N2的转化率。
准确称取6 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛100 mL某浓度的H2SO4溶液烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生沉淀的质量W与加入NaOH溶液的体积V的关系如图所示。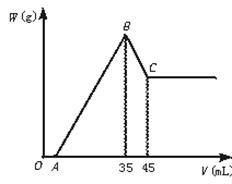
求(1)H2SO4溶液的物质的量浓度是多少?
(2)若A="2.3" mL,铝土矿中Al2O3的质量百分含量是多少?
某空气污染监测仪是根据SO2与Br2的定量反应来测定空气中SO2含量的。反应的溴来自一个装有酸性(稀硫酸)的KBr溶液的电解槽阳极的氧化反应,电解槽的阳极室与阴极室是隔开的。当测定某地区空气中SO2的含量时,空气(已除尘)以1.5×10-4m3/min的流速进入电解槽的阳极室,电流计显示电子通过的速率为8.56×10-11mol/s,此条件下能够保持电解槽中Br2浓度恒定并恰好与SO2完全反应(设空气中不含能与溴反应的其它杂质)。
(1)写出此监测过程中发生反应的化学方程式。
(2)计算该地区空气中二氧化硫的含量[单位:g/(m3空气)]。
氨氧化法可制得50%的HNO3,加脱水剂可进一步制备90%HNO3。两种产品的质量比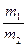 =x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
=x(m1、m2分别为50%的HNO3的质量和90%的HNO3的质量),若以17t液氨为原料生产HNO3。
(1)导出理论所需水量(y)与质量比(x)的关系式(假定NH3的转化率为100%);
(2)求出只生产50%的HNO3所需水的量和只生产90%HNO3所需水的量;
(3)质量比(x)为多少时,进出水的量保持平衡,此时两种产品的总质量为多少?