(10分)Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂,常采用下法制备:将亚硫酸钠溶液与硫粉混合共热,生成硫代硫酸钠Na2SO3+S=Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3·5H2O晶体析出。该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质.
为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的稀H2SO4溶液20mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
| |
第一份 |
第二份 |
第三份 |
| 样品的质量/g |
12.60 |
18.90 |
28.00 |
| 二氧化硫的体积/L |
1.12 |
1.68 |
2.24 |
| 硫的质量/g |
1.28 |
1.92 |
2.56 |
(1)样品与稀硫酸可能发生反应的离子方程式为__________________________________;
_____________________________________________。
(2)根据上表数据分析,该样品_________________________(填选项字母);
A.含有Na2S2O3·5H2O和Na2SO4两种成分
B.含有Na2S2O3·5H2O和Na2SO3两种成分
C.含有Na2S2O3·5H2O、Na2SO3和Na2SO4三种成分
(3)该样品中各成分的物质的量之比为___________________________;
(4)所加硫酸溶液的物质的量浓度为___________________________mol/L。
CO、CH4均为常见的可燃性气体
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比为
(2)已知在101kpa时,CO的 燃烧热为283KJ/mol。相同条件下,若2 molCH4燃烧生成液态水,所放出的热量为1mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是
燃烧热为283KJ/mol。相同条件下,若2 molCH4燃烧生成液态水,所放出的热量为1mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是
(3)120℃、101Kpa下,a ml 由 CO、CH4组成的混合气体在b ml O2中完全燃烧后,恢复到原温度和压强。
CO、CH4组成的混合气体在b ml O2中完全燃烧后,恢复到原温度和压强。
①若混合气体与O2恰好完全反应,产生b ml CO2,则混合气体中CH4的体积分数为(保留2位小数)
②若燃烧后气体体积缩小了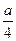 ml,则a与b关系的数学表达式是
ml,则a与b关系的数学表达式是
将10 g铁置于40 mL某浓度的硝酸中,再微热充分反应后,共收集到1792 mL混合气体,溶液里还残留4.4 g固体(标准状况)。求:
(1)反应被还原的硝酸与未被还原的硝酸的物质的量
(2)原硝酸溶液的物质的量浓度
(3)混合气体的组成成分及其体积比
将a mol Na溶于b g水中,a1mol Na2O溶于b1g水中,a2mol Na2O2溶于b2g水中,均能得到质量分数为8%的NaOH溶液。(已知:2Na2O2 + 2H2O ="==4NaOH" + O2↑)
(1)若a1∶a2=1,则b1=b2=(2)若a=0.2,则b=
(3)若b=b1=b2,则a、a1和a2之间的关系式为
0.2 mol有机物和 0.5 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
0.5 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
(1)判断该有机物的化学式。
(2)若0.2 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式。
有机物A和B都含C:40%,H:6.7%,O:53.3%,在标准状况下,A蒸气密度为1.34克/升,B的相对分子量为60,A易溶于水,其水溶液能发生银镜反应。B溶液显酸性。试写出A、B的结构简式及名 称。(要求计算过程)
称。(要求计算过程)