下列实验操作中,正确的是
19.
| A.在CuSO4溶液中滴入少量NaOH溶液,来配制新制Cu(OH)2悬浊液 |
| B.在稀氨水中逐渐加入稀的硝酸银溶液来配制银氨溶液 |
| C.除去苯中的少量苯酚:加入NaOH溶液,振荡、静置分层后,除去水层 |
| D.溴乙烷在氢氧化钠存在下进行水解后,加入硝酸银溶液,可检验溴元素的存在 |
下列平衡体系在体积不变时加入所给物质,平衡可以发生移动的是
A.FeCl3(aq)+3KSCN(aq)  Fe(SCN)3(aq)+3KCl(aq),加入KCl晶体 Fe(SCN)3(aq)+3KCl(aq),加入KCl晶体 |
B.N2(g)+3H2(g)  2NH3(g),通入HCl气体 2NH3(g),通入HCl气体 |
C.CaCO3( s) CaO(s)+CO2(g),加入CaCO3 CaO(s)+CO2(g),加入CaCO3 |
D.2SO2(g)+O2(g) 2SO3(g),通入N2 2SO3(g),通入N2 |
下列反应过程中,ΔH>0且ΔS>0的是
A.CaCO3(s) CaO(s)+CO2(g) CaO(s)+CO2(g) |
B.NH3(g)+HCl(g) NH4Cl(s) NH4Cl(s) |
C.4Al(s)+3O2(g) 2Al2O3(s) 2Al2O3(s) |
D.H2SO4(aq)+Ba(OH)2(aq) BaSO4(s)+2H2O(l) BaSO4(s)+2H2O(l) |
1g H2燃烧生成液态水放出142.9kJ的热量,下列热化学方程式正确的是
A.2H2(g)+ O 2(g) = 2H2O(1)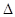 H = —142.9kJ·molˉl H = —142.9kJ·molˉl |
B.2H2(g)+ O 2(g) = 2H2O(1)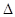 H = —571.6kJ·molˉl H = —571.6kJ·molˉl |
C.2H2+O2 = 2H2O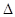 H = —571.6lkJ·molˉl H = —571.6lkJ·molˉl |
D.H2(g)+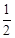 O 2(g) = H2O(1) O 2(g) = H2O(1)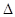 H = +285.8kJ·molˉl H = +285.8kJ·molˉl |
将N2和H2的混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后反应速率为:v甲(H2)=3 mol·L-1·min-1,v乙(N2)=2 mol·L-1·min-1,v丙(NH3)=1 mol·L-1·min-1。这段时间内三个容器中合成氨的反应速率的大小关系为
| A.v甲>v乙>v丙 | B.v乙>v甲>v丙 |
| C.v甲>v丙>v乙 | D.v甲=v乙=v丙 |
在一定条件下,发生CO + NO2 CO2 + NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是
CO2 + NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是
| A.正反应为吸热反应 | B.正反应为放热反应 |
| C.降温后CO的浓度增大 | D.降温后各物质的浓度不变 |