向Fe2O3和铁粉组成的混合物中,加入适量的稀H2SO4,各物质恰好完全反应,测得溶液中不含Fe3+,且Fe2+与H2的物质的量之比为4:1,那么在反应中,Fe2O3、Fe、H2SO4的物质的量之比为( )
| A.1:1:1 | B.1:2:4 | C.1:2:3 | D.2:3:5 |
反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为 反应生成
反应生成 过程中的能量变化,下列说法正确的是
过程中的能量变化,下列说法正确的是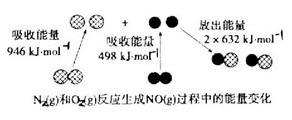
A.通常情况下,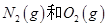 混合能直接生成NO 混合能直接生成NO |
B.1mol 反应放出的能量为180kJ 反应放出的能量为180kJ |
| C.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
D.1mol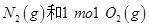 具有的总能量小于2mol 具有的总能量小于2mol  具有的总能量 具有的总能量 |
A、B是短周期VIIA族的两种元素,A的非金属性比B强。下列关于A、B的说法正确的是
A.A元素的单质可以把B元素的单质从NaB溶液中置换出来
B.NaA、NaB的晶体都是离子晶体,且NaA晶体的熔点比NaB高
C.HA的沸点比HB高,是因为1mol HA分子中H-A键断裂时吸附的能量比1mol
HB分子中H-B键断裂时吸收的能量多
D.常温下, 溶液的pH均大于7
溶液的pH均大于7
下列事实中不能证明 是弱电解质的是
是弱电解质的是
A.常温下某 |
B.常温下0.1mol 溶液的pH=2.8 溶液的pH=2.8 |
C. 溶液与稀盐酸反应生成 溶液与稀盐酸反应生成 |
D. 属于共价化合物 属于共价化合物 |
 表示阿伏加德罗常数,下列说法中正确的是
表示阿伏加德罗常数,下列说法中正确的是
A.2.4g镁与足量的盐酸反应,电子转移数目为0.1 |
B.0.5mol/L的 的溶液中含 的溶液中含 个 个 |
C.1mol 固体中含2 固体中含2 个阴离子 个阴离子 |
D.1mol 离子所含电子数为10 离子所含电子数为10 |
某固体混合物含有等物质的量且均为1mol的 四种成分中的某两种。通过实验确定其组成:取少量固体溶于水,得到无色澄清的溶液;向该溶液滴入少量的硝酸铝溶液,看到有白色沉淀生成。该固体混合物的组成是
四种成分中的某两种。通过实验确定其组成:取少量固体溶于水,得到无色澄清的溶液;向该溶液滴入少量的硝酸铝溶液,看到有白色沉淀生成。该固体混合物的组成是
| A.KC1、NaOH | B.KC1、 |
C.NaOH、 |
D.KC1、 |