有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃  )如下表所示:
)如下表所示:
| 第一组 |
He |
-268.8 |
(a) |
-249.5 |
Ar |
-185.8 |
Kr |
-151.7 |
| 第二组 |
F2 |
-187.0 |
Cl2 |
-33.6 |
(b) |
58.7 |
I2 |
184.0 |
| 第三组 |
(c) |
19.4 |
HCl |
-84.0 |
HBr |
-67.0 |
HI |
-35.3 |
| 第四组 |
H2O |
100.0 |
H2S |
-60.2 |
(d) |
-42.0 |
H2Te |
-1.8 |
下列各项中正确的是( )
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
下列装置所示的实验中,能达到实验目的的是()。 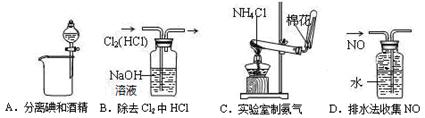
去西藏等高原而患脑水肿的患者吸入低浓度NO气体30分钟后即可清醒。但NO也因污染空气而“臭名昭著”,作为现代化城市引起的NO气体污染其主要来源是…()。
| A.铜和稀硝酸反应 | B.氮气和氧气发生反应 |
| C.二氧化氮气体溶于水 | D.氨的催化氧化 |
利用原料气在合成塔中合成NH3,为加快正反应速率,且提高N2的转化率所采取的措施是()。
| A.加压 | B.移走氨气 | C.使用催化剂 | D.充入N2 |
将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将A g粉末状碳酸钙与同浓度的足量盐酸反应,则相应的曲线(图中虚线所示)正确的是()。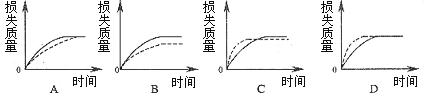
已知气体的相对分子质量越小,扩散速度越快。浓硫酸没有挥发性,浓氨水和浓盐酸都具有很强的挥发性,浓氨水会挥发出氨气,浓盐酸会挥发出氯化氢。下图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是()。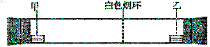
| A.甲是浓氨水,乙是浓硫酸 |
| B.甲是浓盐酸,乙是浓氨水 |
| C.甲是浓氨水,乙是浓盐酸 |
| D.甲是浓硫酸,乙是浓氨水 |