(7分)下图是实验室用于制取、干燥和收集气体的装置图。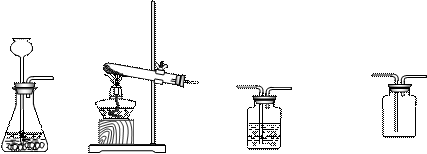
(1)若用装置A制取氧气,装置中放入的药品为:________________ 和_____________。
(2)若用装置B制取氧气,写出一个反应的化学方程式:_______________________
(3)若想用排水法收集干燥的氧气(C中盛满水),则装置端口连接顺序是
a→ → → → 。
某化学兴趣小组利用下图装置进行实验探究,请按要求填空:
(1)A的玻璃管中发生反应的化学方程式为;
(2)B的试管中发生反应的化学方程式为;
(3)C的导气管口放置点燃的酒精灯的目的是。
据下图回答问题: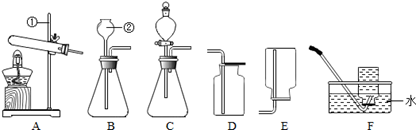
(1)写出图中有标号的仪器名称:①,②。
(2)实验室常用过氧化氢溶液制取氧气,若要控制反应速率,应选择的发生装置是(填字母,下同),该反应的化学方程式为:。
(3)实验室常用加热氯酸钾来制取氧气,制取装置是将组合,该反应的化学方程式为:。
(4)实验室常用碳酸钙和稀盐酸来制取二氧化碳,制取装置是将组合,该反应的化学方程式为:。
下图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请填空:
(1)t2 ℃时30 g a物质加入到50 g水中充分搅拌,能形成80 g溶液吗?(填“能”或“不能”)。
(2)将t2℃的等质量的a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是。
(3)将t1 ℃时a、b、c三种物质饱和溶液的温度升高到t2 ℃时,三种溶液的溶质质量分数大小关系是。
(4)若把t2℃时c物质的饱和溶液变成不饱和溶液,能保持溶质的质量分数不变的方法是。
填写下列表格(“混合物”栏中括号内为杂质):
| 混合物 |
除去杂质的化学方程式 |
| 铜粉(Fe) |
|
| FeCl2溶液(CuCl2) |
下列是初中化学中的一些重要实验,请回答: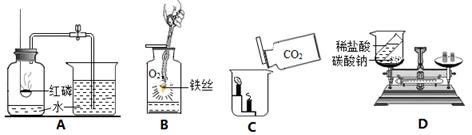
(1)实验A中红磷必须足量的原因是;
(2)实验B中发生反应的化学方程式为;
(3)实验C说明二氧化碳具有的化学性质是;
(4)实验D中反应后天平不平衡,该反应是否遵守质量守恒定律?(填“是”或“否”)。