对有机物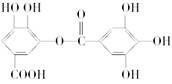 叙述不正确的是
叙述不正确的是
| A.常温下,与Na2CO3溶液反应放出CO2 |
| B.能发生碱性水解,1 mol该有机物能消耗8 mol NaOH |
| C.与稀H2SO4共热生成两种有机物 |
| D.该有机物的化学式为C14H10O9 |
往蓝色的CuSO4溶液中逐滴加入KI溶液可以观察到产生白色沉淀X和生成含有Y物质的棕色溶液。再向反应后的混合物中不断通入SO2气体,并加热,又发现白色沉淀显著增多,溶液逐渐变成无色。则下列分析推理中错误的是
| A.白色沉淀X可能是CuSO3 ,Y可能是I2 |
| B.白色沉淀X可能是CuI,Y可能是I2 |
| C.上述实验条件下,物质的氧化性:Cu2+>I2>SO42- |
| D.上述实验条件下,物质的还原性:SO2 >I->Cu+ |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是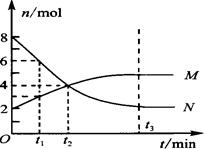
A.反应的化学方程式为:2M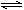 N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
已知热化学方程式:SO2(g)+ 1/2O2(g) 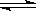 SO3(g)△H = -98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g)△H = -98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
| A.小于196.64kJ | B.196.64kJ/mol | C.196.64kJ | D.大于196.64kJ |
关于热化学方程式:2H2(g)+O2(g)=2H2O(1),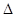 H=-571.6 kJ·mol-1,下列有关叙述不正确的是
H=-571.6 kJ·mol-1,下列有关叙述不正确的是
| A.2mol H2完全燃烧生成液态水时放出571.6 kJ的热 |
| B.1mol H2完全燃烧生成液态水时放出285.8kJ的热 |
| C.2个氢分子完全燃烧生成液态水时放出571.6 kJ的热 |
D.上述热化学方程式可表示为H2(g)+1/2 O2(g)=H2O(1),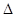 H=-285.8 kJ·mol-1 H=-285.8 kJ·mol-1 |
X、Y、Z、W四种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性强于等电荷数的X阳离子的氧化性;Z阴离子半径大于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小的顺序是
| A.W>X>Y>Z | B.Z>X>Y>W |
| C.X>Y>Z>W | D.Z>Y>X>W |