(9分)叠氮化合物应用广泛,如NaN3可用于汽车安全气囊,PhCH2N3可用于合成化合物V(见下图,仅列出部分反应条件,Ph—代表苯基  )。
)。
(1)下列说法不正确的是________(填字母)。
A.反应①、④属于取代反应
B.化合物Ⅰ可生成酯,但不能发生氧化反应
C.一定条件下化合物Ⅱ能生成化合物Ⅰ
D.一定条件下化合物Ⅱ能与氢气反应,反应类型与反应②相同
(2)化合物Ⅱ发生聚合反应的化学方程式为________(不要求写出反应条件)。
(3)反应③的化学方程式为______________________(要求写出反应条件)。
(4)化合物Ⅲ与PhCH2N3发生环加成反应生成化合物V,不同条件下环加成反应还可生成化合物V的同分异构体 。该同分异构体的分子式为________,结构式为_
。该同分异构体的分子式为________,结构式为_ _________________。
_________________。
(5)科学家曾预言可合成C(N3)4,其可分解成单质,用作炸药。有人通过NaN3与NC—CCl3反应成功合成了该物质。下列说法正确的是________(填字母)。
A.该合成反应可能是取代反应
B.C(N3)4与甲烷具有类似的空间结构
C.C(N3)4不可能与化合物Ⅲ发生环加成反应
D.C(N3)4分解爆炸的化学反应方程式可能为:C(N3)4―→C+6N2↑
火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知N2 (g) + 2O2 (g)=2NO2 (g) △H ="+67.7" kJ/mol
N2H4 (g) +O2 (g)=N2 (g) + 2H2O (g) △H =" -534" kJ/mol
则N2H4和NO2反应的热化学方程式为____________________________________________
根据下面的反应线路及所给信息填空。
(1)A的结构简式是 ,B的结构简式是 ;
(2)①的反应类型是 ;③的反应类型是 ;
(3)反应④的条件是 ;
(4)写出反应②的化学方程式 。
(1)C3H6O2有多种同分异构体,其中属于酯类且能发生银镜反应的有 个,写出其结构简式 。
(2)若用1 mol乙烯和足量的氯气在适当的条件下反应制取四氯乙烷,这一过程中所要经历的反应有 、 (填反应类型)及这一过程中耗用氯气 mol (反应产物中的有机物只有四氯乙烷)。
生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水 。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为 。 (不用写反应条件)
(3)下列属于乙醇的同系物的是 ,属于乙醇的同分异构体的是 。(选填编号)
C.CH3 CH2—O—CH2CH3 D.CH3OH
E.CH3—O—CH3 F.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
①46 g乙醇完全燃烧消耗________mol氧气。
②乙醇在铜作催化剂的条件下可被氧气氧化,反应的化学方程式为_____________________。
③下列说法正确的是________(选填字母)。
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车
C.黄酒中某些微生物将乙醇氧化为乙酸,于是酒就变酸了
D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了乙酸乙酯
(1) 证明溴乙烷中溴元素的存在,有下列几步,其正确的操作顺序是___ _____。
①加入硝酸银溶液 ②加入氢氧化钠溶液 ③加热 ④加入稀硝酸至溶液呈酸性
(2)有机物M结构如下图,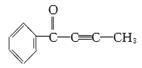 。根据M的结构回答:M中不饱和碳原子有
。根据M的结构回答:M中不饱和碳原子有
个,最多有 个原子共平面。
(3)某烃A和炔烃B的混合物共1L,完全燃烧生成相同状况下的二氧化碳1.4L,水蒸气1.6L,写出两种烃的结构简式.A ;B ,两者物质的量之比为A :B = 。
(4)实验室制取硝基苯的化学反应方程式是 ;试剂加入顺序是 ,该反应需要控制温度,方法是 。