用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
| B.25℃,1.01×105 Pa,32g O2和O3的混合气体所含原子数为2.5NA |
| C.标准状况下,11.2L H2O 含有的分子数为0.5NA |
| D.在常温常压下,44g CO2含有的原子数为3NA |
下列叙述正确的是
| A.NH3是极性分子,分子中N原子是在3个H原子所组成的三角形的中心 |
| B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心 |
| C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央 |
| D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央 |
下列说法正确的是
| A.用乙醇或CCl4可提取碘水中的碘单质 |
| B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C.24Mg32S晶体中电子总数与中子总数之比为1∶1 |
| D.H2S和SiF4分子中各原子最外层都满足8电子结构 |
下列关于晶体的说法一定正确的是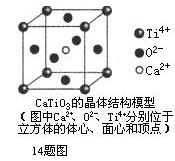
| A.分子晶体中都存在共价键 |
| B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻 |
| C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
| D.金属晶体的熔点都比分子晶体的熔点高 |
PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
| A.PH3分子呈三角锥形 |
| B.PH3分子是极性分子 |
| C.PH3沸点低于NH3沸点,因为P-H键键能低 |
| D.PH3分子稳定性低于NH3分子,因为N-H键键能高 |
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |