高功率Ni/MH(M表示储氢合金)电池已经用于混合动力汽车。总反应方程式如
下: ,下列叙述正确的是
,下列叙述正确的是
| A.放电时正极附近溶液的碱性增强 |
| B.放电时负极反应为:M+H2O+e-==MH+OH- |
| C.充电时阳极反应为:NiOOH+H2O+e-==Ni(OH)2+OH- |
| D.放电时每转移1mol电子,正极有1mol NiOOH被氧化 |
常温下,用0.1000 mol/L HCl溶液滴定 20.00 mL 0.1000 mol/L NH3•H2O,溶液滴定曲线如下图。下列说法正确的是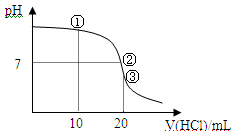
| A.点①溶液中:c(C1—) >c(NH4+)>c(OH—) >c(H+) |
| B.点②溶液中:c(NH4+)>c(C1—)>c(OH—)>c(H+) |
| C.点③溶液中:c(C1—)>c(H+)>c(NH4+)>c(OH—) |
| D.滴定过程中可能出现: c(NH3•H2O)>c(NH4+)>c(OH—)>c(Cl—)>c(H+) |
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.上述电解过程中共转移2 mol电子 |
| B.原混合溶液中c(K+)为2 mol/L |
| C.电解得到的Cu的物质的量为0.5 mol |
| D.电解后溶液中c(H+)为2 mol/L |
已知:Fe2O3(s)+ 3/2C(s)= 3/2CO2(g)+2Fe(s) △H=" +234.1" kJ/mol
C(s)+O2(g)=CO2(g) △H=" -393.5" kJ/mol
则反应2Fe(s)+ 3/2O2(g)=Fe2O3(s)的△H是
| A.-169.4 kJ/mol | B.-627.6 kJ/mol |
| C.-744.7 kJ/mo | D.-824.4 kJ/mol |
已知某酸H2B在水溶液中存在下列关系:①H2B H++HB-,②HB-
H++HB-,②HB- H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
H++B2-。关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是
A.NaHB属于弱电解质
B.溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-)
C.NaHB和NaOH溶液反应的离子方程式为H++OH-===H2O
D.c(Na+)=c(HB-)+c(B2-)+c(H2B)
在容积一定的密闭容器中,反应2A 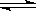 B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
| A.正反应是吸热反应,且A是气态 |
| B.正反应是放热反应,且A不是气态 |
| C.其他条件不变,加入少量A,该平衡不移动 |
| D.改变压强对该平衡的移动无影响 |