设NA为阿伏加德罗常数值,下列说法中正确的是
| A.氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子 |
| B.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| C.NA个一氧化碳分子和0.5mol甲烷(CH4)的质量比为7︰4 |
| D.标准状况下,11.2L氦气所含的原子数为NA |
在0.lmol•L-1Na2CO3溶液中,下列关系正确的是 ( )
| A.[Na+]=2[CO32- ] | B.[OH一]=2[H+] |
| C.[HCO3- ]>[H2CO3] | D.[Na+]<([CO32-]+[HCO3- ]) |
下列离子方程式的书写正确的是()
| A.AlCl3溶液中加入过量NaOH溶液:Al3++3OH-==Al(OH)3↓ |
| B.CuSO4溶液中加入过量Ba(OH)2溶液:Ba2++SO42-==BaSO4↓ |
| C.铜与AgNO3溶液反应:Cu+2Ag+==Cu2++2Ag |
| D.碳酸钙与过量盐酸的反应:CO32-+H+==H2O+CO2↑ |
25℃时,在含有Pb2+、Sn2+的某水溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示下列判断正确的是
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示下列判断正确的是
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应正向为△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,最适宜选
用的试剂是()
| A.Ba(OH)2 | B.NaOH溶液 | C.盐酸 | D.氨水 |
依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s) 设计的原电池如图所示。下列叙述正确的是()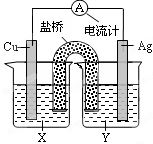
| A.Y为CuSO4溶液 |
| B.正极反应为Cu-2e- = Cu2+ |
| C.在外电路中,电流从Cu极流向Ag极 |
| D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池 |
反应相同