举办“人文奥运”的一个重要体现就是禁止运动员服用兴奋剂。有一种兴奋剂的结构简式如右式,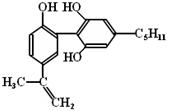
下列有关该物质的说法正确的是
| A.该分子中所有碳原子可以稳定的共存在一个平面中 |
| B.1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol |
| C.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
D.滴入酸性K MnO4溶液,观察到紫色褪去,可证明分子中存在双键 MnO4溶液,观察到紫色褪去,可证明分子中存在双键 |
以下微粒含配位键的是:
①N2H5+②CH4③OH- ④NH4+ ⑤NH3 ⑥Fe(SCN)3 ⑦H3O+ ⑧Ag(NH3)2OH
A.①②④⑦⑧ B ①④⑥⑦⑧ C.③④⑤⑥⑦ D.全部
某些化学键的键能数据如下表所示(kJ·mol-1):
| 键 |
H-H |
Br-Br |
I-I |
Cl-Cl |
H-Cl |
H-I[ |
H-Br |
| 键能 |
436 |
193 |
151 |
247 |
431 |
299 |
356 |
分析上表中数据,下列结论正确的是
A.把1mol Cl2分解为气态原子时,需要放出247 kJ能量
B.由表中所列化学键形成的单质分子中,最稳定的是H2 ,形成的化合物分子中,最不稳定的是HI
C.在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的是I2 > Br2 > Cl2
D.预测1mol H2在足量F2中燃烧比在Cl2中放热少
甲醛,分子式CH2O,有强烈刺激性气味的气体,甲醛在常温下是气态,被世界卫生组织确定为致癌和致畸形物质。下列关于其结构及性质的分析正确的是
| A.C原子采取sp3杂化,O原子采取sp杂化 |
| B.甲醛分子中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 |
| C.甲醛分子与水分子间可以形成氢键,甲醛分子间不能形成氢键 |
| D.甲醛分子为非极性分子 |
在元素周期表中,元素的金属性和非金属性及其强弱比较与周期数(n)和主族数(A)有如下经验公式:K=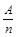 (K为A与n的比值)。下列推理正确的是
(K为A与n的比值)。下列推理正确的是
A.当A一定时,K值越小,则元素的非金属性越强
B.当K=0,则该元素系同一周期中最活泼的金属元素
C.当n一定时,随着K值增大,则元素的非金属性逐渐增强强
D.当K=l时,则该元素系过渡元素,当K<1时,则该元素系金属元素
具有下列电子排布式的原子中,半径最大的是
| A.ls22s22p63s1 | B.1s 22s22p3 22s22p3 |
| C.1s22s22p2 | D.1s22s22p63s23p4 |