某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是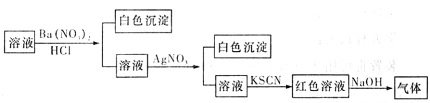
A.原溶液中一定含有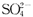 离子 离子 |
B.原溶液中一定含有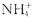 离子 离子 |
C.原溶液中一定含有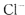 离子] 离子] |
D.原溶液中一定含有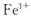 离子 离子 |
用H2O2溶液处理含NaCN的废水的反应原理为:NaCN+H2O2+H2O=NaHCO3+NH3,已知:HCN的酸性比H2CO3弱。下列有关说法正确的是
| A.该反应中氮元素被氧化 |
| B.该反应中H2O2作还原剂 |
| C.0.1mol·L-1NaCN溶液中含有HCN和CN-的总数为0.1×6.02×1023 |
| D.实验室配制NaCN溶液时,需加入适量的NaOH溶液 |
下列有关化学用语表示正确的是
A.质子数为53、中子数为78的碘原子: |
B.N2的电子式: |
C.S2-的结构示意图: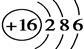 |
| D.丙醛的结构简式:CH3CH2COH |
21世纪化学的最新定义为“化学是一门创造新物质的科学”。下列有关说法不正确的是
| A.用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用 |
| B.开发利用太阳能、生物质能等清洁能源,有利于节约资源 |
| C.绿色化学的核心是应用化学原理对环境污染进行治理 |
| D.制备物质时探究化学反应中高的选择性、转化率和原子利用率,属于“绿色”的生产工艺 |
下列表示对应化学反应的离子方程式正确的是:
| A.向稀HNO3中滴加Na2SO3溶液:SO32—+2H+=SO2↑+H2O |
| B.漂白粉溶液中通入足量二氧化硫气体:ClO-+SO2+H2O===HClO+HSO |
| C.NaHCO3溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
| c/mol·L-1 V/mmol·L-1·min-1 T/K |
0.600 |
0.500 |
0.400 |
0.300 |
| 318.2 |
3.60 |
3.00 |
2.40 |
1.80 |
| 328.2 |
9.00 |
7.50 |
a |
4.50 |
| b |
2.16 |
1.80 |
1.44 |
1.08 |
A.a=6.00 B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2D.不同温度时,蔗糖浓度减少一半所需的时间相同