(5分)A、B、C、D、E是周期表中五种常见的短周期元素,原子序数依次增大。C、D、E最高价氧化物对应的水化物两两均可以相互反应生成盐和水;A的原子序数与C的最外层电子数相同:B的氢化物水溶液显碱性;E的氢化物水溶液为强酸。回答下列问题:
(1) D在周期表中的位置是__________,写出D的氧化物与强酸反应的离子方程式:____________________
(2) B的氢化物呈碱性的原因: ______________________ ________(用方程式表示)
________(用方程式表示)
(3) 用电子式来表示化合物CE的形成过程: _____________________________ _
_
(4) E的单质与 A的一种氧化物反应生成具有漂白性的物质。有关反应的化学方程式为: ________________________________________
A的一种氧化物反应生成具有漂白性的物质。有关反应的化学方程式为: ________________________________________
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-离子,当向该溶液加入某浓度的NaOH溶液时,发现生成沉淀的物质的量 随NaOH溶液的体积变化如图所示,
随NaOH溶液的体积变化如图所示,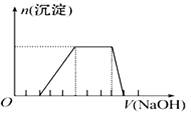
由此可知,该溶液中肯定含有的阳离子是_______________________,且各离子的物质的量之比为_____;肯定不含的阳离子是_____________。
在①H2S②SO2③CO④Cl2⑤HCl五种气体中,能使品红溶液褪色的是_______;通入石蕊试液先变红后褪色的是__________,只变红不褪色的是__________;能使碘化钾淀粉试纸变蓝的是__________;能与溴水反应的是__________。(填序号)
A、B、C、D均为有机化合物。请根据以下框图,回答问题:
(1)B不含有支链,则B的结构简式为,其中含有的官能团是。
(2)C含有支链,在浓硫酸作用下加热反应只能生成一种烯烃D(不考虑立体异构),则D的结构简式为,其名称(系统命名)是。
(3)C在催化剂Cu的作用下被氧气氧化为有机物E,E能发生银镜反应,则C的结构简式为。
(4)写出反应①的化学方程式:,其反应类型是。
(5)物质B有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:。
i)既能发生银镜反应,又能发生水解反应
ii)其核磁共振氢谱有三种类型氢原子的吸收峰
A、B、C、D、E为五种短周期元素,且原子序数依次增大。其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数。C原子的最外层中有两个不成对的电子。D、E的原子核内各自的质子数与中子数相等。C可分别与A、B、D、E形成XC2型化合物(X代表A、B、D、E中的一种元素)。已知在DC2和EC2中,D与C的质量之比为7:8;E与C的质量之比为1:1。请回答下列问题:
(1)基态D原子的电子排布式为,单质B2中 键与
键与 键的数目之比为
键的数目之比为
(2)化合物BH3(H代表氢元素)的立体构型为____,B原子的杂化轨道类型 是。
(3)C和E的最简单氢化物分别为甲和乙,请比较相同条件下甲、乙的沸点大小,并说明理。
(4)A可以形成多种结构不同的单质,其中M是所有已知晶体中硬度最大的,其晶体类型是;若该晶体晶胞(如图所示)的边长为a cm,则其密度是g·cm -3(只要求列式,不必计算出数值,阿伏加德罗常数为NA)。
某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见 化合物的性质。过程如下:
化合物的性质。过程如下:
【提出问题】
①在周期表中,Cu、Al位置接近。Cu不如Al活泼,Al(O H)3具有两性,Cu(OH)2也具有两性吗?
H)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③Cu0有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、、(填试剂名称),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80—100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,则A的化学式为。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
实验中观察到Cu0变为红色物质。查资料可知,同时生成一种无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是。
(2)根据实验方案(2),得出的+1价Cu相+2价Cu稳定性大小的结论是:在高温时。在酸性溶液中。
(3)CuO能够被NH3还原。
【问题讨论】
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?