元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下表是元素周期表的部分内容,请认真分析并回答后面的问题:
| |
IA |
|
0 |
||||||
| 1 |
1 H 氢 1.008 |
2 He 氦 4.003 |
|||||||
| IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
||||
| 2 |
3 Li 锂 6.941 |
4 Be 铍 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
|
| 3 |
11 Na 钠 22.99 |
12 Mg 镁 24.31 |
13 Al 铝 26.98 |
14 Si 硅 28.09 |
15 P 磷 30.97 |
16 S 硫 32.06 |
17 Cl 氯 35.45 |
18 Ar 氩 39.95 |
(1)请从上表中查出地壳中含量最多的金属元素的相对原子质量为_________。
(2)表中不同种元素最本质的区别是_________(填序号):
A.相对原子质量不同 B.质子数不同 C.中子数不同
(3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如: (填字母序号)、……
A.从左到右,各元素原子的电子层数相同
B.从左到右,各元素原子的原子序数依次增加
C.从左到右,各元素原子的最外层电子数相同
(4)元素周期表中,原子序数为12的镁元素的原子结构示意图如图,该原子在化学反应中易_____________(填“得到”或“失去”)电子。说明元素的化学性质与原子的_________________关系密切。
在宏观、微观和符号之间建立联系是化学学科的特点。
(1)氢、碳和氧的原子结构示意图如图1所示,回答下列问题。

①x的值是 。
②碳属于 (填“金属”或“非金属”)元素。
③氢元素和碳元素组成的一种物质乙烯(C2H4)是重要的基本化工原料。由乙烯的化学式C2H4获得的信息有 。
(2)近年来,我国科研人员在“甲烷﹣二氧化碳重整和Ni基催化剂”的研究方面取得突破。如图2是甲烷与二氧化碳反应的微观示意图。

①在框内补充C的微观模型图。
②该反应利用两种温室气体,兼具环保和经济价值;反应难点之一是破坏甲烷分子、二氧化碳分子的稳定结构,分为 (填微粒名称)并重新组合。
③写出该反应的化学方程式 。
拥有丰厚绿色生态资源、多彩民族文化资源的贵州,正成为越来越多的国内外游客向往的心灵栖息之地。这些美不胜收的自然资源、人文资源中,蕴藏着无穷的化学奧秘。
请回答下列问题。
(1)在生态理念深入人心的贵阳享美食。写出保护空气的一条措施 。卤猪脚、酸汤鱼和丝娃娃等美食中所含的营养素有 (写一种)。
(2)丰富的水资源成就了黄果树大瀑布美丽的景观。请写出保护水资源的一条建议 。“安顺蜡染”工序中的脱蜡,把染布放入沸水中,石蜡固体熔化为液体的过程属于 (填“化学”或“物理”)变化。
(3)游加榜梯田,在美丽乡村感受脱贫致富奔小康的巨变。农作物生长要合理施肥。硫酸钾(K2SO4)和氯化铵(NH4Cl)是常用的化肥,其中 是钾肥, 是氮肥。
根据如图回答问题。
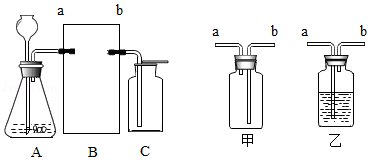
(1)反应原理
①加热高锰酸钾、分解过氧化氢溶液或加热氯酸钾均可产生氧气,其中分解过氧化氢溶液和加热氯酸钾时,加入二氧化锰在反应中起的作用是 。三种方法中,写出其中一个反应的化学方程式 。
②石灰石和稀盐酸反应产生二氧化碳的化学方程式为 。
(2)制取O2和CO2.连接如图的装置完成实验。
|
制取气体 |
A |
B |
C |
||
|
反应物 |
装置(填“甲”或“乙”) |
物质 |
作用 |
作用 |
|
|
O2 |
① |
② |
水 |
③ |
接水 |
|
CO2 |
石灰石和稀盐酸 |
乙 |
④ |
干燥CO2 |
⑤ |
面对新冠肺炎疫情,要严格防控,科学消毒。体积分数为75%的医用酒精能够破坏新型冠状病毒的脂质包膜分子并使其蛋白质变性,从而杀灭病毒。
(1)乙醇(C2H5OH)俗称酒精。乙醇属于 (填“有机物”或“无机物”)。
(2)探究乙醇能溶解在水中。在盛有2mL水的试管中滴入3滴红墨水,再缓慢加入2mL乙醇,如图,补充完成实验。
|
实验操作 |
实验现象 |
实验结论 |
|
|
|
乙醇能溶解在水中形成溶液 |
(3)配制医用酒精。把100mL体积分数为95%的酒精(没有消毒作用),加水稀释为75%的医用酒精,下列仪器不需要的是 (填序号)。
A.烧杯
B.药匙
C.玻璃棒
D.量筒
(4)科学使用医用酒精。阅读下列材料。
|
物质 |
最小爆炸限度% (空气中的体积分数) |
最大爆炸限度% (空气中的体积分数) |
闪点(℃) |
|
乙醇 |
3 |
19 |
12.8(医用酒精为22) |
|
柴油 |
0.6 |
7.5 |
>62 |
闪点指的是挥发性物质所挥发的气体与火源接触下会闪出火花的最低温度。
①从燃烧的角度,结合材料中的信息简述:使用医用酒精消毒时,应避免火源引发火灾甚至爆炸的原因有 。
②在家里,使用医用酒精对门把手、桌面和文具等物品进行消毒的正确方式是 (填“擦拭”或“喷洒”)。

在宏观、微观和符号之间建立联系是化学学科的特点。
(1)氢、碳和氧的原子结构示意图如图1所示,回答下列问题。
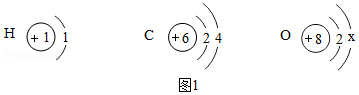
①x的值是 。
②碳属于 (填“金属”或“非金属”)元素。
③氢元素和碳元素组成的一种物质乙烯(C2H4)是重要的基本化工原料。由乙烯的化学式C2H4获得的信息有 。
(2)近年来,我国科研人员在“甲烷﹣二氧化碳重整和Ni基催化剂”的研究方面取得突破。如图2是甲烷与二氧化碳反应的微观示意图。
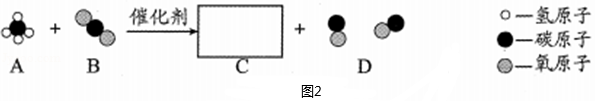
①在框内补充C的微观模型图。
②该反应利用两种温室气体,兼具环保和经济价值;反应难点之一是破坏甲烷分子、二氧化碳分子的稳定结构,分为 (填微粒名称)并重新组合。
③写出该反应的化学方程式 。