在密闭容器中,反应X2(g) +Y2(g)
+Y2(g)  2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
A.图Ⅰ是加入适当催化剂的变化情况   |
B.图Ⅱ是扩大容器体积的变化情况 |
| C.图Ⅲ是增大压强的变化情况 | D.图Ⅲ是升高温度的变化情况 |
在蒸发皿中加热蒸干并灼烧(低于400℃)下列物质的溶液,可以得到该物质固体的是
| A.氯化铝 | B.碳酸氢钠 |
| C.硫酸镁 | D.高锰酸钾 |
下列关于平衡常数K的说法中,正确的是( )
| A.在任何条件下,化学平衡常数是一个恒定值 |
| B.改变反应物浓度或生成物浓度都会改变平衡常数K |
| C.平衡常数K只与温度有关,与反应浓度、压强无关 |
| D.从平衡常数K的大小不能推断一个反应进行的程度 |
在1 L含0.1 mol NaAlO2和0.1 mol Ba(OH)2的混合溶液中,逐滴加入浓度为0.1 mol/L的H2SO4溶液,下列图象 中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是
中能表示反应产生沉淀的物质的量与加入硫酸溶液体积之间关系的是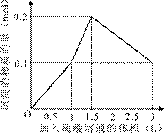

A B
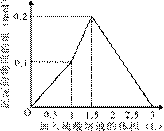
C D
在标准状况下,三个干燥的烧瓶内分别装入:干燥纯净的NH3、含有部分空气的HCl气体、体积比为4:10的NO2与O2的混合气体。分别做喷泉实验,最终三个烧瓶中所得溶液的物质的量浓度(假设溶液不外渗)之比为()
| A.2:1:2 | B.5:5:4 | C.1:1:1 | D.无法确定 |
下列各组物质,化学键类型相同,熔化时所克服的作用力也完全相同的是()
| A.二氧化碳与二氧化硅 | B.氯化钠与氯化氢 |
| C.碳酸铵与尿素 | D.氢化钠与氯化钠 |