下列离子方程式书写正确的是
| A.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: 3ClO—+Fe(OH)3= FeO42—+3Cl—+H2O+4H+ |
| B.用Na2O2与H2O反应制备O2:Na2O2+ H2O=2Na++2OH-+ O2↑ |
| C.向Fe(NO3)2溶液中加入过量的HI溶液 3Fe2++NO-3+4H+-=3Fe3++NO↑+2H2O |
| D.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合 |
HCO-3+Ba2++OH-=BaCO3↓+H2O
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池。下图为RFC工作原理示意图,有关说法正确的是:()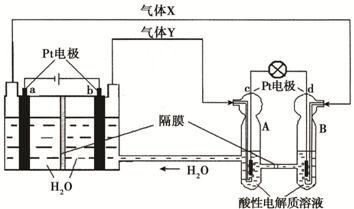
A.当有0.1 mol电子转移时,a极产生标准状况下1.12 L H2
B.左端装置中化学能转化为电能,右端装置中电能转化为化学能
C.c极上发生的电极反应是:O2 + 2H2O+ 4e- = 4OH—
D.d极上进行还原反应,右端装置B中的H+可以通过隔膜进入A
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1盐酸和20.00 mL 0.1000 mol·L-1醋酸溶液,得到两条滴定曲线,如下图所示,若以HA表示酸,下列说法正确的是
A.滴定盐酸的曲线是图2
B.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
C.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
D.当0 mL<V(NaOH)<20.00 mL时,对应混合液中各离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-)
设NA为阿伏加德罗常数的值,下列叙述正确的是:( )
| A.常温常压下,22.4 L乙烯中C—H键数为4 NA |
| B.1 mol羟基中电子数为10NA |
| C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA |
| D.常温下,1 L 0.1 mol/L NH4NO3溶液中NH4+的数目小于6.02×1022 |
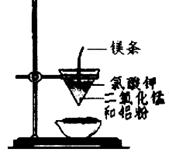
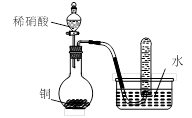
用下图所示装置进行实验,不能达到实验目的的是:()
甲乙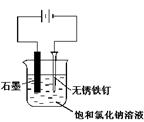
丙丁
| A.用甲装置比较硫、碳、硅三种元素的非金属性强弱 |
| B.用乙装置可制得金属锰,用同样的装置可制得金属铬 |
| C.用丙装置可实现对铁钉的保护 |
| D.用丁装置验证铜与稀硝酸反应的气体产物只有NO |
下列判断错误的是:( )
| A.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHS04溶液混合,生成白色沉淀:Ba2++SO42‾+H++OH‾ =BaSO4↓+H2O |
| B.常温下,等物质的量浓度的三种溶液①(NH4)2CO3;②NH4Cl;③(NH4)2Fe(SO4)2中c(NH4+):①<②<③ |
| C.加入苯酚显紫色的溶液中:K+、NH4+、Cl-、I- 四种离子不能大量共存 |
D.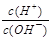 =1×10-12的溶液: K+、AlO2-、CO32-、Na+四种离子可以大量共存 =1×10-12的溶液: K+、AlO2-、CO32-、Na+四种离子可以大量共存 |