小美在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有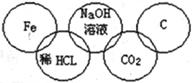
| A.复分解反应、1个 | B.分解反应、2个 |
| C.化合反应、3个 | D.置换反应、2个 |
在密闭容器中一定量混合气体发生反应:x A (g) + y B(g)  z C(g)平衡时测得A的浓度为 0.5 mol/l,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.2mol/l,下列判断正确的是
z C(g)平衡时测得A的浓度为 0.5 mol/l,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.2mol/l,下列判断正确的是
| A.x+y ﹥ z | B.平衡向正反应方向移动 |
| C.B的转化率降低 | D.C的体积分数保持不变 |
.已知反应A2(g)+2B2(g)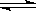 2AB2(g)△H<0,下列说法正确的是
2AB2(g)△H<0,下列说法正确的是
A升高温度有利于反应速率增加,从而缩短达到平衡的时间
B升高温度,正向反应速率增加,逆向反应速率减小
C达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D达到平衡后,降低温度 或减小压强都有利于该反应平衡正向移动
或减小压强都有利于该反应平衡正向移动
已知:H+(aq)+OH-(aq)===H2O(l)△H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,,则△H1、△H2和△H3的大小关系为
| A.△H1==△H2>△H3 | B.△H3>△H2>△H1 |
| C.△H2>△H1>△H3 | D.△H3>△H1>△H2 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
A.C(s)+1/2 O2(g)=CO(g) △H=" ―393.5" kJ/mol △H=" ―393.5" kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)△H=" +571.6" kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=" ―890.3" kJ/mol |
| D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l)△H=" ―2800" kJ/mol |
准确量取25.00mL KMnO4溶液,可选用的仪器是
| A.50mL量筒 | B.10mL量筒 |
| C.50mL酸式滴定管 | D.50mL碱式滴定管 |