己知:HCN(aq)与NaOH(aq)反应的∆H= —12.1kJ/mol;HCl(aq)与NaOH(aq)反应的
∆H= —55.6kJ/mol。则HCN在水溶液中电离的∆H等于
| A.—67.7 kJ/mol | B.—43.5 kJ/mol | C.+43.5 kJ/mol | D.+67.7kJ/mol |
在一定温度下的定容密闭容器中,当反应A2(g)+B2(g) 2AB(g)达到平衡的标志()
2AB(g)达到平衡的标志()
| A.单位时间内生成nmolA2的同时也生成nmolAB |
| B.容器内的压强不随时间变化而变化 |
| C.单位时间内生成nmolA2的同时也生成nmolB2 |
| D.单位时间内生成2nmolAB的同时也生成nmolB2 |
在一定条件下,可逆反应:mA+nB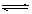 pC达到平衡,若:
pC达到平衡,若:
(1)A、C是气体,增加B的量,平衡不移动,则B为态。
(2)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是。
(3)加热后,可使C的质量增加,则正反应是反应(放热或吸热)。
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是()
| A.反应混合物的浓度 | B.反应体系的压强 |
| C.正、逆反应的速率 | D.反应物的转化率 |
设C+CO2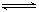 2CO-Q1(吸热反应)反应速率为 u1,N2+3H2
2CO-Q1(吸热反应)反应速率为 u1,N2+3H2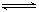 2NH3+Q2(放热反应)反应速率为 u2,对于上述反应,当温度升高时,u1和u2的变化情况为()
2NH3+Q2(放热反应)反应速率为 u2,对于上述反应,当温度升高时,u1和u2的变化情况为()
| A.同时增大 | B.同时减小 | C.增大,减小 | D.减小,增大 |
可以充分说明反应P(g)+Q(g) R(g)+S(g)在恒温下已达到平衡的是()
R(g)+S(g)在恒温下已达到平衡的是()
| A.反应容器内的压强不随时间改变 |
| B.反应容器内P、Q、R、S四者浓度之比为1:1:1:1 |
| C.P的生成速率和S的生成速率相等 |
| D.反应容器内的气体总物质的量不随时间变化 |