甲、乙两瓶稀氨水的浓度分别是1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH—)之比为
| A.大于10 | B.小于10 | C.等于10 | D.无法确定 |
M的名称是乙烯雌酚,它是一种激素类药物,结构简式如下。下列叙述不正确的是()
| A.M的分子式为C18H20O2 |
| B.M可与NaOH溶液或NaHCO3溶液均能反应 |
| C.1 mol M最多能与7 mol H2发生加成反应 |
| D.1 mol M与饱和溴水混合,最多消耗5 mol Br2 |
塑化剂是一种对人体有害的物质。增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得: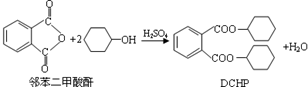
下列说法正确的是( )
| A.邻苯二甲酸酐的二氯代物有3种 |
| B.环己醇分子中所有的原子可能共平面 |
| C.DCHP能发生加成、取代和消去反应 |
| D.1molDCHP最多可与含2molNaOH的溶液反应 |
醇类化合物在香料中占有重要的地位,下面所列的是一些天然的或合成的醇类香料:
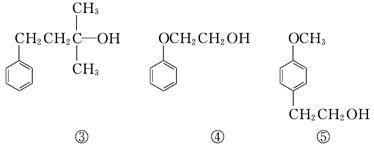
下列说法中正确的是()
| A.可用酸性KMnO4溶液检验①中是否含有碳碳双键 |
| B.②和③互为同系物,均能催化氧化生成醛 |
| C.④和⑤互为同分异构体,可用核磁共振氢谱检验 |
| D.等物质的量的上述5种有机物与足量的金属钠反应,消耗钠的量相同 |
某酯分子式为C6H12O2,该酯水解后生成A和B,B是A的同分异构体的氧化产物,该酯为()
| A.CH3CH(CH3)COOC2H5 | B.CH3CH2COO(CH2)2CH3 |
| C.CH3COO(CH2)3CH3 | D.CH3CH2COOCH(CH3)2 |
下列离子方程式正确的是()
| A.乙酸与碳酸钠溶液反应:2H++CO32-== CO2↑+H2O |
| B.澄清石灰水中加入过量的碳酸氢钠溶液:Ca2+ + HCO + OH-= CaCO3↓ + H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O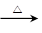 2C6H5OH+CO32- 2C6H5OH+CO32- |
D.甲醛溶液与足量的银氨溶液共热HCHO+4[Ag(NH3)2]++4OH- CO32-+2NH4++ 4Ag↓+ 6NH3↑+ 2H2O 。 CO32-+2NH4++ 4Ag↓+ 6NH3↑+ 2H2O 。 |