下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合化学和生物学科的知识,回答下列问题。
配料表 |
精制海盐、碘酸钾 |
| 含碘量 |
20~40mg/kg |
| 卫生许可证号 |
××卫碘字(1999)第001号 |
| 分装日期 |
见封底 |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹调时,待食品熟后加入碘盐 |
(1)要在食盐中加碘,是因为碘是人体内合成____________激素的主要原料,缺碘会引起疾病。
(2)食盐中加碘,这碘指的是 (填
 化学式),其中碘元素的化合价为__________。
化学式),其中碘元素的化合价为__________。
(3)根据含碘盐的食用方法,可推测碘酸钾在受热时容易___________________。
)单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。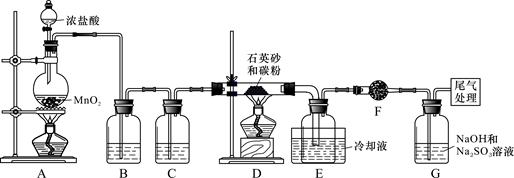
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解,有关物质的物理常数见下表:
| 物质 |
SiCl4 |
AlCl3 |
FeCl3 |
| 沸点/℃ |
57.7 |
- |
315 |
| 熔点/℃ |
-70.0 |
- |
- |
| 升华温度/℃ |
- |
180 |
300 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是。
(2)装置C中的试剂是; D、E间导管短且粗的原因是。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3:。
【设计方案,进行实验】可供选择的实验试剂有:3mol/LH2SO4、1mol/LNaOH、0.01mol/LKMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
| 序号 |
操作 |
可能出现的现象 |
结论 |
| ① |
向a试管中滴加几滴溶液 |
若溶液褪色 |
则假设1成立 |
| 若溶液不褪色 |
则假设2或3成立 |
||
| ② |
向b试管中滴加几滴溶液 |
若溶液褪色 |
则假设1或3成立 |
| 若溶液不褪色 |
假设2成立 |
||
| ③ |
向c试管中滴加几滴溶液 |
假设3成立 |
(13分)某研究性学习小组欲探究Na2CO3溶液与MgCl2溶液反应产生白色沉淀的成分,小组成员做如下实验
(1)若按所得的结论分析,甲观察到的实验现象是___________________________。
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥。同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点。
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3)___Ksp [Mg(OH)2](选填“<”或“>”),所以沉淀物未必是MgCO3。经查阅资料得知:该白色沉淀的组成应为Mgx(OH)y(CO3)z·nH2O。为确定沉
淀物的具体组成,他设计下图装置进行实验(所有夹持装置已省略)。
(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③________________________________________________________;
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量。
(5)装置E中碱石灰的作用是_________________________________________________。
三次实验所得数据如下:(部分数据已换算为相应的物质的量)
(6)分析实验数据可知,第_________组出现误差较大的数据,应舍去。由实验数据计算
得该白色沉淀物的组成为___________(选填序号)。
a.Mg2(OH)2CO3·3H2O b.Mg(OH)2(CO3)2·3H2O
c.Mg4(OH)2(CO3)3·3H2O d.Mg5(OH)4(CO3)3·2H2O
实验室可用MnO2和KClO3混合加热的方法制取氧气:2KClO3 2KCl+3O2↑
2KCl+3O2↑
I.现有下列仪器或装置:
(1)A-D装置中,用作KClO3为原料制氧气的反应装置是____(填序号)。
(2)排水法收集氧气,接口顺序是:氧气出口→___→___→g→h→烧杯(填序号)。
Ⅱ.KClO3分解时尚有副反应,导致收集到的气体有异味。据推测,副产物可能是O3、Cl2、ClO2中的一种或几种。资料表明:O3、Cl2、ClO2的沸点依次为-111℃、-34℃和11℃,且O3、ClO2也能将KI氧化为I2。为探究副反应气体产物的成分,将KClO3分解产生的气体经干燥后通入如右装置进行实验:
(3)若要确认副产物中含Cl2,F中应盛放_____溶液。
(4)确定副产物中含有ClO2的现象是_________________。
(5)实验时若D中无现象,E中试纸变蓝,能否得出副产物含有臭氧的结论?
答:_____ (填“能”或“不能”)。理由是________________________________。
Ⅲ.ClO2是饮用水消毒剂。用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2-。为测定此饮用水中两者成分,进行如下实验:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I- =I2+2ClO2-,反应结束后产生amolI2;继续调节溶液pH=1,又发生如下反应:ClO2-+4H++4I- =2I2+Cl-+2H2O,反应结束后叉产生bmolI2。
(6)饮用水中c(ClO2-)=_____________mol·L- 1(用含字母的代数式表示)。
某同学设计了如图所示装置进行石油分馏的实验。
(1)指出实验装置中仪器A、B、C、D的名称:
A________、B________、C________、D________。
(2)指出该同学所设计的实验装置中存在的错误,并给予改正。
错误:①_______________________________________;
②_____________________________________________。
改正:①_______________________________________;
②_____________________________________________。
(3)实验装置改正后,进行气密性检查的方法:______________________________。
(4)蒸馏烧瓶中放入几片碎瓷片的作用是__________________________________。
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下: (1)实验操作③的名称是________,所用主要仪器名称为________。
(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量(填序号)________溶液,反应的离子方程式______________________。
A.KIO3B.HClO C.KID.Br2
(4)利用碘的有机溶液得到单质I2的方法是_______________________________________。