今有一混合物的水溶液,只可能含有以下离子中的若干种:K+,NH4+,Cl-,Mg2+,Ba2+,CO32—,SO42—,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
①K+一定存在 ②100mL溶液中含0.01molCO32—
③Cl-可能存在 ④Ba2+一定不存在,Mg2+可能存在
| A.①②③ | B.①③ | C.①②④ | D.②③ |
下列图示中关于铜电极的连接错误的是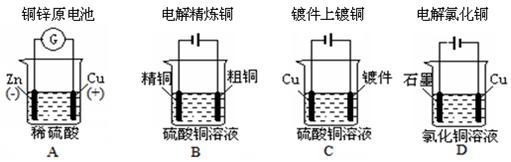
下列事实不能用勒夏特列原理解释的是
A.氯水中有平衡:Cl2+H2O HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 HCl+HClO,当加入AgNO3溶液后,溶液颜色变浅 |
B.对CO(g)+NO2(g) CO2(g)+NO(g),平衡体系增大压强可使颜色变深 CO2(g)+NO(g),平衡体系增大压强可使颜色变深 |
| C.升高温度能够促进水的电离 |
| D.SO2催化氧化成SO3的反应,往往加入过量的空气 |
下列说法正确的是
| A.pH=5的盐酸,再加水冲稀1000倍,溶液的pH=8 |
| B.给稀醋酸溶液加热,溶液pH值增大 |
| C.pH=1的盐酸中c(H+)是pH=3的盐酸的100倍 |
| D.在H2CO3溶液中,C(H+) :C(CO32—-)=2∶1 |
高温下,某反应达平衡,平衡常数 。恒容时,温度升高,
。恒容时,温度升高,
H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
B.该反应化学方程式为:CO + H2 O CO2 + H2 CO2 + H2 |
| C.增大压强,H2浓度一定不变 |
| D.升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2 Cd+2NiOOH+2H2O由此可知,该电池充电时在阴极上发生反应的是
Cd+2NiOOH+2H2O由此可知,该电池充电时在阴极上发生反应的是
| A.Cd(OH)2 | B.Ni(OH)2 | C.Cd | D.NiOOH |