(共11分)某盐X由非金属元素组成,不稳定加热时分解,生成等物质的量的气态氢化物A和B。A、C、E、G、I含有同种元素,C为黄色固体单质。B、D、F、H、J含有同种元素,B可与 J反应生成盐。W是前四周期含有4个未成对电
J反应生成盐。W是前四周期含有4个未成对电 子的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题:
子的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题:
(1)X的化学式
(2)写出由E生成G的化学反应方程式
(3)写出反应B+Y →D+Z的化学方程式
(4)由E直接转换成I可以加入 (填写两种属于不同类别的物质)。
(5)标况下,4.48LA与J的浓溶液反应转移1.6mole-,写出此反应的离子方程式 。
(6)将1mol/L200mL I和1mol/L100mL J溶液混合,加入到含有0.5mol的W中,则产生气体的物质的量为
某一无色透明溶液A,焰色反应呈黄色。当向溶液中通入二氧化碳时则得到浑浊液B,B加热到70OC左右,浑浊液变澄清。此时向溶液中加入少量的饱和溴水,立即有白色沉淀C产生。分别写出A、B、C的名称和结构简式:
A:;B:;C:。
完成有关反应的化学方程式:
按顺序写出实现下列转化的化学方程式
CH3CH2Br → CH3CH2OH→CH2==CH2 →CH2BrCH2Br
(1)
(2)
(3)
给下列有机物命名
A.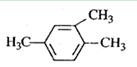 |
B.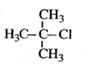 |
C.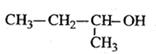 |
D.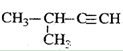 |
配平并完成下面离子方程式:
HCl + KClO3=Cl2 + KCl+ [ ]
(1)写出离子方程式:
硫酸钠溶液与氯化钡溶液
铝片与硝酸汞溶液。
(2)写出与下列离子方程式相对应的化学方程式:
H+ + OH-= H2O
Cu2+ + Fe=" Cu" + Fe2+。