在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是:
A .+4 B.+5 C.+6 D.+7
.+4 B.+5 C.+6 D.+7
将2 mol SO2, 1 mol O2充入带活塞的密闭容器中,发生反应2SO2(g)+ O2(g)  2 SO3(g),达到平衡后,改变下列条件,SO3的平衡浓度不改变的是
2 SO3(g),达到平衡后,改变下列条件,SO3的平衡浓度不改变的是
| A.保持温度和容器的压强不变,充入1mol SO3(g) |
| B.保持温度和容器的容积不变,充入1mol SO3(g) |
| C.保持温度和容器的压强不变,充入1mol O2(g) |
| D.保持温度和容器的压强不变,充入1mol Ar |
铁-镍蓄电池放电和充电时发生的反应为:
Fe + NiO2 +2H2O  Fe(OH)2 + Ni(OH)2
Fe(OH)2 + Ni(OH)2
关于此蓄电池的下列说法中不正确的是
| A.放电时铁为负极 |
| B.充电时阴极的电极反应式为:Ni(OH)2-2e- = NiO2 +2H+ |
C.放电时NiO2的反应为:NiO2 + 2H2O +2e- = Ni(OH)2 + 2 |
| D.蓄电池的电极必须浸在碱性电解质溶液中 |
已知反应mX(g)+nY(g ) 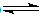 qZ(g);△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g);△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
| A.通入稀有气体使压强增大,平衡将正向移动 |
| B.X的正反应速率是Y的逆反应速率的m/n倍 |
| C.降低温度,混合气体的平均相对分子质量变小 |
| D.若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
下列关于铜电极的叙述正确的是
| A.铜锌原电池中铜是负极 |
| B.用电解法精炼粗铜时粗铜作阴极 |
| C.在镀件上电镀铜时可用金属铜作阳极 |
| D.电解稀硫酸制H2、O2时铜作阳极 |
下列叙述正确的是( )
| A.2.4g金属镁变为镁离子时失去的电子数为0.1NA |
| B.1 mo1/L盐酸中含1 mo1HCl分子 |
| C.在标准状况下,22.4LCH4与18gH2O所含有的分子数均为NA |
| D.22.4L的CO气体与lmol N2所含的原子数一定相等 |