过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
| A.Na2O2 +2HCl= 2NaCl+H2O2 |
| B.Ag2O+ H2O2=2Ag+O2↑+ H2O |
| C.2 H2O2 =" 2" H2O+O2↑ |
| D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
1)H2O2仅体现氧化性 的反应是(填代号) 。
的反应是(填代号) 。
2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
在密闭容器中,发生反应H2 (g)+ I2 (g)  2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。
2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。
(1).升高温度,v正v逆
(2).加入催化剂, v正v逆
(3).充入更多的H2 , v正v逆
(4).取出一定量的I2 , v正v逆 (5).增大容器的体积, v正v逆
(5).增大容器的体积, v正v逆
(6).容器的体积不变,通入氖气, v正v逆
己知NO2与NaOH溶液的反应为3NO2+2NaOH=2NaNO3+NO+H2O,而NO、NO2与NaOH溶液的反应为NO2+NO+2NaOH=2NaNO2+H2O,欲用VL某烧碱溶液将含有nmolNO和mmolNO2的混合气全部吸收,则该烧碱溶液的物质的量浓度至少为________。
下图是某同学自己设计的装置:用大塑料瓶子截去瓶底,留瓶口一段约8cm~10cm,瓶口配一胶塞由里向外塞紧。A、B两极是用镀铬曲别针伸直做成,由塞子露头处连接导线。试回答:其所用电源为 电,由图可知A端为 极;与A端相连接的试管中得到的气体是 ,可用 来检验。
烷烃A只可能有三种一氯取代产物B、C和D。C的结构简式是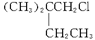 。B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示。
。B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示。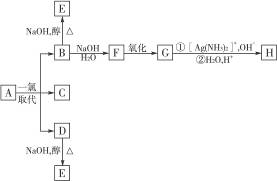
请回答:
(1)A的结构简式是_________________________________________________________。
(2)H的结构简式是_________________________________________________________。
(3)B转变为F的反应属于__________________反应(填反应类型名称)。
(4)B转变为E的反应属于__________________反应(填反应类型名称)。
(5)1.16 g H与足量NaHCO3作用,标准状况下可得CO2的体积是_______________mL。
在有机反应中,反应物相同而反应条件不同,可得到不同的主产物。下式中R代表烃基,副产物均已略去。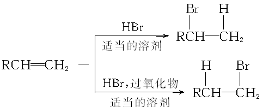
(请注意H和Br所加成的位置)
请写出实现下列转变的各步反应的化学方程式,特别注意要写明反应条件。
(1)由CH3CH2CH2CH2Br分两步转变为CH3CH2CHBrCH3
(2)由(CH3)2CHCH==CH2分两步转变为(CH3)2CHCH2CH2OH