在实验室里制取少量FeCl3,可按照一定顺序连接下图中所列装置,所通过的气体过量且反应充分。试回答以下问题: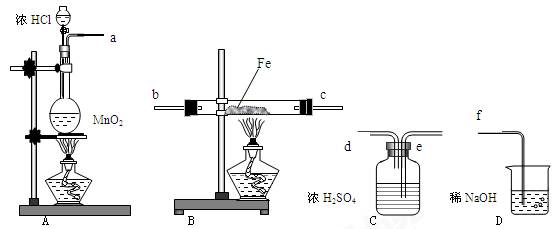
(1)实验时,各装置接口的连接顺序为 (用a、b、c、d等字母表示);
(2)C装置的作用是 ;
(3)D装置的作用是 ;
(4)检验B装置中反应后铁是否有剩余的方法是: ;
(5)用此方法可制得无水氯化铁。你认为能否改用Fe和盐酸反应,再通入过量氯气、蒸干溶液的方法来制取无水氯化铁, (答:是 或否);说明理由: 。
或否);说明理由: 。