用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.2.4g镁原子变成离子时,失去的电子数为0.3NA |
| B.22.4L甲烷(CH4)所含的原子数为5NA |
| C.98 g H2SO4和98 g H3PO4所含的氧原子数都是4NA |
| D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为 NA |
对于可逆反应N2(g)+3H2(g)  2NH3(g) △H<0,下列研究目的与示意图相符的是( )
2NH3(g) △H<0,下列研究目的与示意图相符的是( )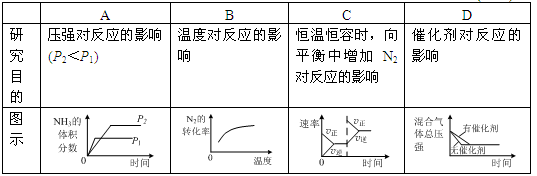
低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) △H<0。在恒容的密闭容器中,下列有关说法正确的是: ( )
2N2(g)+3H2O(g) △H<0。在恒容的密闭容器中,下列有关说法正确的是: ( )
| A.平衡时,其他条件不变,增加NH3的浓度,反应速率会降低 |
| B.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡 |
| C.其他条件不变,充入氦气,化学反应速率不变。 |
| D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
pH=11的X、Y两种碱溶液各10mL,分别稀释至1000mL。其pH与溶液体积(V)的关系如图所示,下列说法正确的是()
| A.X、Y两种碱的物质的量浓度一定相等 |
| B.稀释后,X溶液碱性比Y溶液碱性强 |
| C.若9<a<11,则X、Y都是弱碱 |
| D.完全中和X、Y两溶液时,消耗同浓度盐酸的体积VX>VY |
在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+, 对于该平衡,下列叙述正确的是: ( )
CH3COO-+H+, 对于该平衡,下列叙述正确的是: ( )
| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.通入少量HCl气体,溶液中PH值增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
对于化学反应能否自发进行,下列说法中正确的是()
| A.吸热的化学反应,常温下可能自发 |
| B.熵增加的反应,常温下一定能自发 |
| C.自发反应只有在恰当条件下才能实现 |
| D.若ΔH>0,ΔS<0,任何条件下都不能自发进行 |