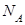 表示阿伏加德罗常数的值。下列说法正确的是
表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,5.6L四氯化碳含有的分子数为0.25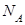 |
B.标准状况下,14g氮气含有的核外电子数为5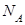 |
C.标准状况下,22.4L任意比的氢气却氧气的混合气体中含有的分子总数均为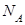 |
D.标准状况下,铝跟氢氧化钠溶液反应生成lmoI氢气时,转移的电子数为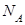 |
下图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是
| A.该反应是吸热反应 |
| B.使用催化剂后反应热减小 |
C.热化学方程式为CO(g)+2H2(g) = CH3OH(g)△H=-510 kJ·mol-1  |
| D.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化 |
同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是
| A.2KMnO4 + 5H218O2 + 3H2SO4 = K2SO4 + 2MnSO4 + 518O2↑ + 8H2O | |
B.2Na218O2 + 2H2O = 4Na18OH + O2↑ |
C.NH4Cl + 2H2ONH3·2H2O + HCl |
| D.K37ClO3 + 6HCl = K37Cl + 3Cl2 ↑+ 3H2O |
某溶液中含有NO3-、SiO32-、AlO2-、S2-等4种离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的氢氧化钠溶液,则溶液中离子数目大量减少的是
| A.只有S2- | B.S2-和NO3- | C.SiO32-、S2-和NO3- | D.四种离子都减少 |
设NA为阿佛加德罗常数,下列叙述不正确的
| A.5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA |
| B.5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA |
| C.50 mL 12 mol•L-1浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D.常温常压下,46g NO2 与N2O4的混合气体中含有的原子总数为3NA |
能正确表示下列反应的离子方程式是
A.将氯气溶于水制备次氯酸:Cl2 + H2O 2H+ + Cl- + ClO— 2H+ + Cl- + ClO— |
| B.碳酸氢钙与过量的NaOH溶液反应 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| C.NaOH溶液中通入少量二氧化硫:SO2+ 0Hˉ= HSO3- |
| D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |