某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂。请填写下列空白:
(1)取25.00mL的待测NaOH溶液于锥形瓶中,并加入2-3滴甲基橙,左手控制酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化。当达到滴定终点时, 溶液由 色变为 色。
溶液由 色变为 色。
(2)若滴定开始和结束时,酸式滴定管中的液面如图1、图2所示,则所用盐酸溶液的体积为 _____ mL。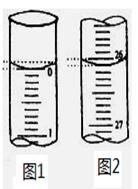
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____________。
| A.酸式滴定管未用标准液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 |
待测氢氧化钠溶液的体积/mL |
0.1000mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
请用上述数据计算该NaOH溶液的物质的量浓度。c(NaOH)= 。
下列化学反应ΔH的数值(放热)最大的是
| A.NaOH(aq)+HCl(aq)=NaCl(aq )+H2O(l);△H1 |
B.NaOH(aq)+ H2SO4(aq)= H2SO4(aq)= Na2SO4(aq)+H2O(l);△H2 Na2SO4(aq)+H2O(l);△H2 |
| C.CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3 |
D.NaOH(aq)+ H2SO4(浓)= H2SO4(浓)= Na2SO4(aq)+H2O(l);△H4 Na2SO4(aq)+H2O(l);△H4 |
在20℃时某化学反应的速率为0.15 mol•L-1•s-1,若温度每升高10℃,反应速率提高到原来的3倍,则为使反应速率达到1.35 mol•L-1•s-1,应使反应在什么温度下进行
| A.30℃ | B.35℃ | C.40℃ | D.45℃ |
下列说法不正确的是
| A.能够发生化学反应的碰撞是有效碰撞 |
| B.正反应进行的程度大、正反应速率一定大 |
| C.反应物的总能量高于生成物的总能量时,发生放热反应 |
| D.化学平衡发生移动时、化学反应速率一定变化 |
下列冶炼方法中,可将化合物中的金属元素还原为金属单质的是
| A.铝粉与氧化镁高温共热 | B.加热CaCO3 | C.电解熔融NaCl | D.加热Al2O3 |
下列热化学方程式中△H代表燃烧热的是
| A.CH4 ( g ) + 3/2O2 ( g ) = 2H2O ( l ) + CO ( g )△H1 |
| B.S ( s ) + 3/2O2 ( g ) = SO3 ( s )△H2 |
| C.C6H12O6 ( s ) + 6O2 ( g ) = 6CO2 (g) + 6H2O ( l )△H3 |
| D.2CO ( g ) + O2 ( g ) = 2CO2 ( g )△H4 |