如果盐酸的浓度是醋酸浓度的二倍,则该盐酸中H
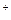 浓度与该醋酸中H
浓度与该醋酸中H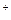 浓度的关系是 ( )
浓度的关系是 ( )
| A.前者是后者的2倍 | B.前者比后者的2倍大 |
| C.前者比后者的2倍小 | D.无法判断 |
300mL某浓度的NaOH溶液中含有60g溶质,现欲配制1mol/LNaOH溶液,应取原溶液与蒸馏水的体积比约为
| A.1∶4 | B.1∶5 | C.2∶1 | D.2∶3 |
将溶质的质量分数为a%、物质的量浓度为c1mol/L的稀H2SO4加热蒸发掉一定量的水,使溶质的质量分数变为2a%,此时硫酸的物质的量浓度为c2mol/L,则c1和c2的数值关系是
| A.c2=2c1 | B.c2<2c1 | C.c2>2c1 | D.c1=2c2 |
要配制浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是 (填代号)。
| A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mL |
| C.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |
NA代表阿伏加德常数,下列说法正确的是
| A.在同温同压时,相同体积的任何气体单质所含的原子数目相同 | |
| B.2g氢气所含原子数目为NA | |
| C.在常温常压下,11.2L氮气所含的原子数目为NA |
D.17g氨气所含电子数目为10NA |
下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不记)。其中能表示等质量的氢气与氦气的是
A. |
B. |
C. |
D. |