已知断裂1 mol H—H 键、H—N键分别吸收436 kJ、391kJ热量,根据热化学方程式:N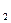 (g)+3H
(g)+3H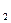 (g)="==" 2NH
(g)="==" 2NH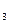 (g) △H= -92.4kJ/mol,则断裂 1 mol N≡N键需要吸收的热量为( )
(g) △H= -92.4kJ/mol,则断裂 1 mol N≡N键需要吸收的热量为( )
| A.431 kJ | B.649kJ | C.945.6kJ | D.869 kJ |
a mol氨完全氧化成HNO3,并且全部溶于反应生成的水中,得HNO3的质量分数约为
| A.78% | B.42% | C.50% | D.63% |
在100 g浓度为18 mol·L-1,密度为ρ(g·cm-3)的浓硫酸中加入一定量的水稀释成9 mol·L-1的硫酸,则加入水的体积
| A.小于100 mL | B.等于100 mL |
| C.大于100 mL | D.小于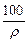 mL mL |
20℃时,将某盐R的溶液蒸发掉10 g水后恢复到20℃,需再加6 g盐R(无水),溶液即达饱和,若将原溶液蒸发掉30 g 水,只需加1 g盐R就可在20℃时达饱和。则20℃时盐R的溶解度是
| A.20 g | B.25 g | C.30 g | D.35 g |
X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径,Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的关系是
| A.X>Y>Z | B.Y>X>Z | C.Z>X>Y | D.Z>Y>X |
若短周期中的两种元素可以形成原子个数比为2:3的化合物,则这两种元素的原子序数之差不可能是
| A.1 | B.2 | C.5 | D.6 |