容量瓶上没有标记的是:
| A.标线 | B.温度 | C.物质的量浓度 | D.容量 |
某烷烃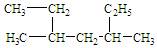 系统命名法正确的是
系统命名法正确的是
| A.2,4-二乙基戊烷 | B.3-甲基-5-乙基己烷 |
| C.4-甲基-2-乙基己烷 | D.3,5-二甲基庚烷 |
下列有关化学用语使用正确的是
A.聚丙烯的结构简式为: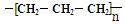 |
B.四氯化碳分子的电子式: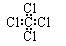 |
C. 的名称为:2,4,4-三甲基-1-戊烯 的名称为:2,4,4-三甲基-1-戊烯 |
D.乙醇分子比例模型: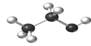 |
涂改液是一种使用率较高的文具,经实验证明,涂改液中含有苯的同系物和卤代烃。下列说法不正确的是
| A.涂改液危害人体健康、污染环境 |
| B.中小学生最好不用或慎用涂改液 |
| C.苯的同系物和卤代烃没有刺鼻气味 |
| D.苯的同系物和卤代烃是涂改液中的溶剂 |
“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制得产物,即原子利用率100%。以下反应最符合绿色化学的是
| A.CH2=CH2与HCl反应制取CH3CH2Cl | B.CH4与Cl2反应制取CCl4 |
| C.苯与液溴反应制取溴苯 | D.乙醇与金属钠反应制取乙醇钠 |
等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2的物质的量之比为
| A.3︰4︰1 | B.3 ︰3︰2 | C.6︰7︰3 | D.6 ︰9︰0 |