请根据构造原理,写出下列元素基态原子的电子排布式:
(1)C 。(2)Ne 。
(3)S 。(4)32Ge 。
。
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子层结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于____________晶体,俗名为____________。
(2)R的氢化物分子的空间构型是____________;属于________分子(填“极性”或“非极性”)它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是____________。
(3)X的常见氢化物的空间构型是____________;它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是____________。
(4)Q分别与Y、Z形成的共价化合物的化学式是________________和________________;Q与Y形成的分子的电子式是____________,属于____________分子(填“极性”或“非极性”)。
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。SiC____________Si;SiCl4____________SiO2。
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。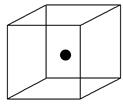
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。
Ⅰ.已知下列金属晶体:Na、Po、K、Fe、Cu、Mg、Zn、Au。其堆积方式为:
(1)简单立方堆积的是____________________________________________;
(2)钾型的是______________________________________________________;
(3)镁型的是______________________________________________________;
(4)铜型的是_____________________________________________________。
Ⅱ.A、B、C、D都是短周期元素,原子半径D>C>A>B,已知:A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。
试回答:
(1)这四种元素分别是:A______,B______,C______,D______(填元素名称)。
(2)这四种元素单质的熔点由高到低的顺序是________(填元素名称)。
(3)C的固态氧化物是________晶体,D的固态单质是________晶体。
(4)写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式_______________________________________________________________。
今有aX、bY、cZ三种元素。已知:①各原子序数a、b、c均小于20且a+b+c=25;②元素Y的原子外围电子构型为ns2npn+2;③X和Y在不同条件下可形成X2Y和X2Y2两种化合物,Y和Z在不同条件下可形成ZY和ZY2两种化合物;④Z的硫化物的相对分子质量与Z的氯化物的相对分子质量之比为38∶77,据上可推知:
(1)X________,Y________,Z________(写元素符号)。
(2)X2Y2是________晶体,构成晶体的微粒是________,该晶体中含有________(填其微粒间作用)。
(3)Z的硫化物和氯化物的分子空间构型分别是__________、________,其中Z原子分别以________、________杂化轨道成键,按照成键方式来分类,Z的硫化物中的共价键类型和数目是___________________________________。
现有甲、乙、丙三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心),可推知,甲晶体中X与Y的个数比是________,乙中A与B的个数比是________,丙晶胞中有________个C离子,有________个D离子。