在一密闭容器中反应mA(g) nB(g)+nC(g)达到平衡。保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍。则
nB(g)+nC(g)达到平衡。保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍。则
| A.平衡向逆反应方向移动 | B.物质A的转化率增加 |
| C.物质C的质量分数增加 | D.m >2n |
同温同压下,等质量的CO和CO2 气体相比较,下列叙述中正确的是:
| A.所含碳原子数比为1∶1 | B.体积比为11∶7 |
| C.密度比为11∶7 | D.分子数比为7∶11 |
相同物质的量的不同固体或液体的体积并不相同,其主要原因是:
| A.粒子大小不同 | B.粒子质量不同 | C.粒子间距离不同 | D.粒子间作用力不同 |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是
2NH3(g),673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是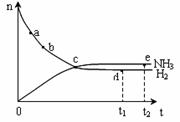
| A.点c处反应达到平衡 |
| B.点d (t1时刻)和点e (t2时刻)处n(N2)不一样 |
| C.其他条件不变,773K下反应至t1时刻,n(H2)比上图中的d点值要大 |
| D.点a的正反应速率比点b的小 |
.对于可逆反应 2AB3(g) 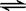 A2(g) + 3B2(g) △H>0,下列图像正确的是
A2(g) + 3B2(g) △H>0,下列图像正确的是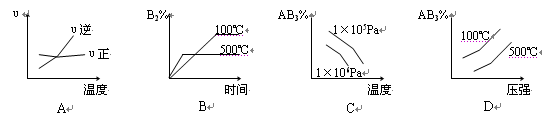
一定质量的无水乙醇完全燃烧时放出的热量为Q,它生成的CO2用过量饱和石灰水完全吸收可得100gCaCO3沉淀。则完全燃烧1mol无水乙醇时放出的热量是
| A. 0.5Q | B. 2Q | C. Q | D. 5Q |