增大压强对下列反应的速率无影响的是
| A.CO2(g)+Ca(OH)2=CaCO3↓+H2O |
B.H2+I2(g)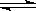 2HI 2HI |
| C.NaCl+AgNO3=AgCl↓+NaNO3 |
D.N2+3H2 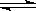 2NH3 2NH3 |
下列四个数据是不同条件下测出的合成氨的反应的速率,其中最慢的是()
| A.v(NH3)="0.15" mol/L·min | B.v(H2)="0.1" mol/L·min |
| C.v(N2)="0.1" mol/L·min | D.v(N2)="0.002" mol/L·s |
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应,2A(g) + B(g)  2C(g) 若经 2 s 后测得 C 的浓度为 0.6 mol/L ;
2C(g) 若经 2 s 后测得 C 的浓度为 0.6 mol/L ;
现有下列几种说法:①用物质 A 表示的反应的平均速率为 0.3 mol/(L · s)②用物质 B 表示的反应的平均速率为 0.6 mol/(L · s)③ 2 s 时物质 A 的转化率为 70 %④ 2 s 时物质 B 的浓度为 0.7 mol/L 其中正确是()。
| A.①③ | B.①④ | C.②③ | D.③④ |
用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成原电池——燃料电池,该电池放电时发生的反应为CH4+2KOH+2O2===K2CO3+3H2O,下列说法错误的是( )
| A.通甲烷的一极为负极,通氧气的一极为正极 |
| B.放电时,通入O2一极附近溶液的pH升高 |
| C.放电一段时间后,KOH的物质的量不发生变化 |
| D.通甲烷极的电极反应式是:CH4+10OH--8e-===CO32-+7H2O |
如图所示装置中,观察到电流表指针偏转;M棒变粗,N棒变细,由此判断下表所列M、N、P物质,其中可以成立的是 ( )
已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol;②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
| A.稀硫酸与稀NaOH溶液的中和热为57.3 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |