化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g)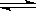 N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)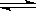 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g)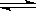 2CO(g)+O2(g) K3=
2CO(g)+O2(g) K3= 4×10-92
4×10-92
以下说法正确的是
| A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2) |
| B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 |
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>C O2 O2 |
| D.以上说法都不正确 |
下列离子方程式书写不正确的是
| A.过量铁粉与稀HNO3反应:3Fe+8H++2NO3-= 3Fe2++2NO↑+4H2O |
| B.向氧化铁中加入氢碘酸发生反应: Fe2O3+6H++2I- = 2Fe2++I2+3H2O |
| C.用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑ |
| D.向溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2=2Fe3+ + 2Br2+ 6Cl- |
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是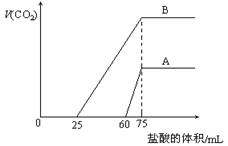
A.A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3和NaHCO3
B.B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为: OH-+H+=H2O H++CO32-=HCO3-
C.B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL
D.原NaOH溶液的物质的量浓度为1.0mol/L
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):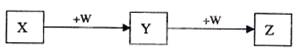
下列说法不正确的是
| A.若W是单质铁,则Z溶液可能是FeCl2溶液 |
| B.若W是氢氧化钠,则X与Z可反应生成Y |
| C.若W为氧气,则Z与水作用(或溶于水)可能生成一种强酸 |
| D.若X是金属镁,则W可能是强氧化性的单质 |
设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下4.6g NO2和N2O4混合气体所含原子总数为0.3NA |
| B.标准状况下,22.4L SO3的分子数为NA |
| C.将标准状况下11.2L的Cl2通入足量水中发生反应,转移的电子总数为0.5NA |
| D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠 |
常温下,下列溶液中一定能大量共存的离子组是
| A.含有大量Fe3+的溶液:SO32-、Na+、Cl-、SO42- |
| B.能使氢氧化铝迅速溶解的溶液:Na+、Fe2+、NO3-、SO42- |
| C.水电离产生的c(H+)=1×10-12mol/L的溶液:SO42-、NH4+、Cl-、Ca2+ |
| D.pH=0的溶液:NH4+、Na+、SO42-、Fe3+ |