在含有Fe3+、Al3+、H+的溶液中滴加NaOH溶液时,下列关于生成沉淀的质量与滴入NaOH溶液体积的关系,图示中正确的是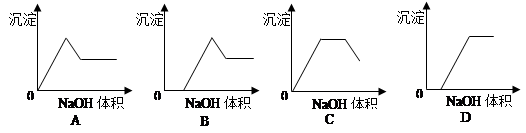
下列关于Al、Fe、Cu的说法正确的是
| A.三种金属单质放置在空气中均只生成氧化物 |
| B.保存Fe2(SO4)3溶液时需要加入铁钉 |
| C.无需另选试剂就可以鉴别浓度均为0.1 mol·L-1的三种金属的硫酸盐 |
| D.三种金属的活泼性:Al>Cu>Fe |
下列各组离子,可能大量共存于无色溶液中的是
| A.Na+、H+、CO32-、NO3- | B.Fe2+、Mg2+、Cu2+、Cl- |
| C.Ba2+、Cl-、NO3-、OH- | D.Mg2+、OH-、HCO3-、Cl- |
已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是
| A.KClO3是氧化剂 |
| B.被氧化与被还原的氯元素的质量比为5:1 |
| C.H2SO4既不是氧化剂又不是还原剂 |
| D.1mol KClO3参加反应时有10mol电子转移 |
NA为阿伏加德罗常数,下列叙述正确的是
| A.28gCO和N2混合气体中含有原子总数为2NA |
| B.标准状况下,22.4 L水所含的H2O分子数为NA个 |
| C.足量铜与1L 18mol·L-1浓硫酸反应可以得到SO2的分子总数为9NA |
| D.1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为2NA |