新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,这说明镁合金具有的优异性能是:①熔点低②硬度大③延展性好④导电性强⑤密度小⑥耐腐蚀
| A.①②③ | B.②③④ | C.①③⑥ | D.②⑤⑥ |
为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中( )
| A.通入氯气 | B.加入Zn | C.加入Fe | D.加入Cu |
向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是()
| A.AgNO3溶液 | B.NaOH溶液 | C.水 | D.KBr溶液 |
关于盐酸、硫酸、硝酸的说法正确的是( )
| A.都是含氧酸 | B.都属于强电解质 |
| C.都容易挥发 | D.都能与金属Mg发生置换反应产生氢气 |
光导纤维的主要成分是()
| A.Cu | B.SiO2 | C.Al2O3 | D.FeS |
放射性核素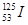 可用于治肿瘤,该核素中子数是( )
可用于治肿瘤,该核素中子数是( )
| A.19 | B.53 | C.72 | D.125 |