设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.1L1mol·L-1的盐酸溶液中,所含氯化氢分子数为NA |
| B.1molNa2O2与水充分反应,转移电子数为1NA |
| C.标准状况下,22.4 L己烷所含分子数为NA |
| D.1.8g重水中所含质子数为NA |
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是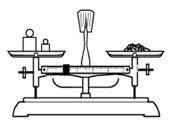
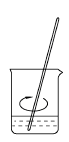
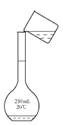
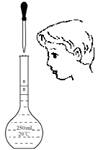
| A.称量 | B.溶解 | C.转移 | D.定容 |
氯气用途广泛,可用于生产半导体硅,生产的流程如下,下列说法不正确的是
| A.①③是置换反应,②是化合反应 |
| B.高温下,焦炭与氢气的还原性均强于硅 |
| C.任一反应中,每消耗或生成28 g硅,均转移4mol电子 |
| D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅 |
多硫化钠Na2Sx(x>2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1︰13,则x的值是
| A.5 | B.4 | C.3 | D.2 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。则下列判断不正确的是
| A.若氧化产物比还原产物多0.35mol,有0.050molKNO3被氧化 |
| B.若氧化产物比还原产物多0.35mol,生成8.96LN2(标准状况) |
| C.若有0.2mol氧化剂反应,则转移电子的物质的量为1.0mol |
| D.KNO3的氧化性强于N2 |
下列解释事实的方程式不准确的是
| A.绿矾久存,表面变黄褐色:4(FeSO4·7H2O)+O2=4Fe(OH)SO4+26H2O |
| B.不能用玻璃塞试剂瓶盛放强碱性溶液:SiO2+2OH-=SiO32-+H2O |
| C.淡黄色的过氧化钠粉末久存,表面变白:2Na2O2=2Na2O+O2 |
| D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O |