下列与化学反应能量变化相关的叙述正确的是
| A.生成物能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.同温同压下,H2(g)+Cl(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:N2(g)+3H2 (g) 2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2NH3 (g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
| 改变条件 |
新平衡与原平衡比较 |
|
| A |
增大压强 |
N2的浓度一定变小 |
| B |
升高温度 |
N2的转化率变小 |
| C |
充入一定量H2 |
H2的转化率不变,N2的转化率变大 |
| D |
使用适当催化剂 |
NH3的体积分数增大 |
根据下图,下列判断中正确的是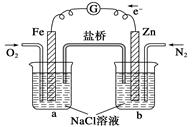
| A.烧杯a中的溶液pH不变 |
| B.烧杯a中发生氧化反应 |
| C.烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
| D.烧杯b中发生的反应为Zn-2e-=Zn2+ |
2007年度诺贝尔化学奖,授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德•埃特尔,表彰他在“固体表面化学过程”研究中作出的贡献。下列说法中正确的是
| A.工业生产中,合成氨采用压强越高,温度越低,越有利于提高经济效益。 |
| B.增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率 |
| C.采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快 |
| D.增大催化剂的表面积,能增大氨气的产率 |
化学与科学、技术、社会和环境密切相关。下列有关说法中错误的是
| A.对废旧电池进行回收处理,主要是为了环境保护和变废为宝 |
| B.用电解水的方法制取大量H2,可以缓解能源不足的问题 |
| C.大力开发和应用氢能源有利于实现“低碳经济” |
| D.工业上,不能采用电解MgCl2溶液的方法制取金属镁 |
A、B、C、D为短周期主族元素,且原子序数依次增大。已知A原子的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子。下列说法正确的是
A.非金属性:A>B
B.原子半径:C>D>A>B
C.元素B和C只能形成一种化合物
D.A、C、D的最高价氧化物对应的水化物均能相互反应