从手册上查得:H-H、Cl-Cl和 H-Cl的键能分别为436、243和431 kJ·mol-1,请用此数据估计,由Cl2、H2生成1molH-Cl 时的热效应
A放热183 kJ·mol-1 B放热91.5kJ·mol-1 C吸热183kJ·mol-1 D吸热91.5kJ·mol-1
N2(g)+3H2(g) 2NH3(g)△H=-92.4 kJ·mol-1。恒容时, 体系中各物质浓度随时间变化的曲线如图示。下列说法不正确的是()
2NH3(g)△H=-92.4 kJ·mol-1。恒容时, 体系中各物质浓度随时间变化的曲线如图示。下列说法不正确的是()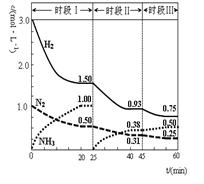
| A.前20分钟反应内放出的热量为46.2kJ |
| B.第25分钟改变的条件是将NH3从反应体系中分离出去 |
| C.若第60分钟时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度 |
| D.时段Ⅰ仅将初始投放的物质浓度增至原来的2倍,则反应物的转化率增大,平衡常数不变 |
现有一种简单可行的测定阿伏加德罗常数的方法,具体步骤为:(1)将固体NaCl细粒干燥后,准确称出m克NaCl固体并转移到定容仪器a中。(2)用滴定管b向a仪器中滴加某液体c,不断振荡,加至a仪器的刻度线,计算出NaCl固体的体积为Vcm3,再通过NaCl的体积和质量,即可算出阿伏加德罗常数.上述操作中的abc分别指 ()
| A.容量瓶、酸式滴定管、四氯化碳 | B.容量瓶、碱式滴定管 、苯 |
| C.量筒、碱式滴定管、水 | D.量筒、酸式滴定管、水 |
据报道,科学家发现了如下反应:O2+PtF6→O2(PtF6)。已知O2(PtF6)为离子化合物,其中Pt为+5价。对于此反应,下列说法正确的是()
| A.此反应是非氧化还原反应 |
| B.O2(PtF6) 中氧元素的化合价是+1价 |
| C.在此反应中,O2是氧化剂,PtF6是还原剂 |
| D.此反应中,每生成1mol O2(PtF6)转移1mol 电子 |
下列化学用语的相关表述正确的有 ( )
| A.H+(aq)+OH-(aq)=H2O(l) ΔH=" -a" kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ |
| B.因CuSO4·5H2O(s)=CuSO4(s)+5H2O(l) ΔH="+b" kJ/mol,故1 mol CuSO4(s)溶于水时,放出热量b kJ |
| C.因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(l)=2H2(g)+O2(g) ΔH="+c" kJ/mol |
D.因N2(g)+3H2(g)  2NH3(g) ΔH=" -" d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ 2NH3(g) ΔH=" -" d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
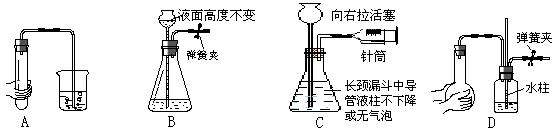
下列各图所示装置的气密性检查中,漏气的是()