25℃时,水的电离达到平衡:H2O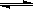 H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加人稀氨水 ,平衡逆向移动,c(OH―)降低 ,平衡逆向移动,c(OH―)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 |
| C.向水中加人少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,Kw增大,pH不变 |
下列有关表达式中不正确的是()
A.乙烷的电子式: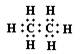 |
B.乙烯的结构式: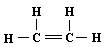 |
C.乙醇的结构式: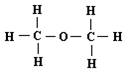 |
D.乙酸的结构简式:CH3COOH |
淀粉和纤维素都可以用(C6H10O5)n表示其分子组成,它们是()
| A.同分异构体 | B.同系物 | C.同种物质 | D.多糖类物质 |
下列物质中能导电的是()
| A.蔗糖溶液 | B.乙醇溶液 | C.乙酸溶液 | D.乙酸乙酯 |
北京奥运会的“祥云”火炬所用燃料为丙烷,下列有关丙烷的叙述中不正确的是()
| A.比甲烷的沸点高 | B.与乙烷互为同系物 |
| C.分子中的碳原子不在一条直线上 | D.可发生加成反应 |
下列有关维生素和微量元素叙述不正确的是
| A.维生素C大量存在于猪肉中 | B.维生素C大量存在于绿色植物中 |
| C.人体缺碘容易引起甲状腺肿大 | D.人体缺铁易患缺铁性贫血 |