一定温度下,将3molA气体和1molB气体通入一密闭容器中,发生如下反:3A(g)+B(g) xC(g)
xC(g)
请填写下列空白:
(1)若容器体积固定为 2L,反应2min时测得剩余0.6mol B,C的浓度为0.4mol/L。
①2min内,A的平均反应速率为 ;x= ;
②若反应经4min达到平衡,平衡时C的浓度  0.8mol/L(填“大于”、“等于”或“小于”)
0.8mol/L(填“大于”、“等于”或“小于”)
③平衡混合物中,C的体积分数为22%,则B的转化率是 ;
④改变起始物加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的质量的量n(A)、n(B)、n(C)之间应该满足的关系式为 。(请用2个等 式表示)
式表示)
(2)若维持容器压强不变
①达到平衡时C的体积分数 22%,(填“大小”、“等于”或“小于”)
②改变起始物质加入质量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入 molA气体和 molB气体。
在你已学知识范围内选择正确的物质填空,以满足下列转化的要求:A、B、C可以是物质也可以是该物质的溶液: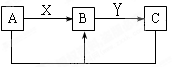
(1)X、Y均为CO2气体,A的化学式:,
A与C反应的离子方程式:
(2)X、Y均为稀盐酸,C为气体,A的化学式:,
A与C反应的离子方程式:
(3)X、Y均为NaOH溶液,A的化学式:,
A与C反应的离子方程式:
(4)X为稀盐酸,Y为Cl2,A的化学式:,
A与C反应的离子方程式:
下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
⑥ |
⑦ |
||||||
| 三 |
① |
③ |
⑤ |
⑧ |
⑩ |
|||
| 四 |
② |
④ |
⑨ |
(1) ⑧⑨三种元素形成的气态氢化物最稳定的是___________________________。
(2) 写出①的最高价氧化物对应的水化物的电子式________。
(3) ②③④中形成的简单离子半径由大到小的顺序是________________________。
(4) 用电子式表示元素⑦的氢化物的形成过程________,该氢化物与元素⑧的单质反应的离子方程式是______________________________。
(5) ①和⑨两元素形成化合物的化学式为_________________________,该化合物的溶液与元素⑧的单质反应的离子方程式为___________________。
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂
夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极。在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电。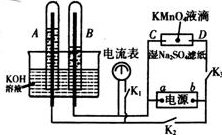
(1)写出B中电极反应式__________。
(2)在湿的硫酸钠溶液滤纸条中部的高锰酸钾液滴处发生的现象是______________。
(3)电解一段时间后,A、B中均有气体包围电极,此时切断K2、K3,闭合K1,则电流表的指针________(填。是”或。否”)移动,其理由是_______________________。
(4)在298K,若2g B 气体和0.5mol的A 气体完全反应,生成物为液态,放出
285・8kJ热量,写出此反应的热化学方程式:__________________________________。
在一定温度下,将2molA和2molB两种气体混合放入体积为2L的密闭刚性容器中,发生如下反应: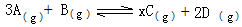
2min末反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol•L-1请回答:
(1)x的值为_______(2)A的转化率为________
(3)此温度下该反应的平衡常数K=
(4)若在同样的条件下,开始时加入C 、 D 各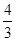 mol,要使平衡时各物质的百分含量与上述平衡相同,则还要加入______mol______ 物质.
mol,要使平衡时各物质的百分含量与上述平衡相同,则还要加入______mol______ 物质.
(5)保持温度不变,往同一容器中通入A、B、C、D各1mol,该反应向方向移动。
将足量AgCl分别放入:①5ml水②10ml 0.2mol·L-1 MgCl2溶液③20ml 0.5mol·L-1 NaCl溶液,④40ml 0.1mol·L-1盐酸中溶解溶解至溶液饱和,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是_____________________;0.2mol·L-1 NH4Cl溶液中离子浓度大小关系是_______________。