有一包从海水中获得的粗盐,已经经过初步的提纯。课外活动小组对它的成分进行探究,并将粗盐进一步提纯。
探究一:这包粗盐中还含有什么杂质?
根据海水的成分和初步提纯的实验操作,估计该粗盐可能还含有的杂质是CaCl2和MgCl2。现用实验验证这种推测:取样并溶解,加入数滴NaOH溶液,目的是检验是否会有 (填化学式,下同);接着再加入数滴Na2CO3溶液,目的是检验是否会有 。实验证明这包粗盐含有的杂质是CaCl2 。
。
探究二:这包粗盐中NaCl的质量分数是多少?
按下面步骤进行实验:①称取一定质量的样品; ②将样品加水溶解,制成粗盐溶液;③向粗盐溶液中加入过量的某种试剂,过滤;④沉淀洗涤后小心烘干,得到纯净固体A;⑤溶液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;⑥称量实验中得到的某种固体。
②将样品加水溶解,制成粗盐溶液;③向粗盐溶液中加入过量的某种试剂,过滤;④沉淀洗涤后小心烘干,得到纯净固体A;⑤溶液在进行某一操作后,移入蒸发皿蒸发,得到纯净固体B;⑥称量实验中得到的某种固体。
(1)②、③、⑤的步骤中,都使用到同一仪器 (填名称),它在步骤②和⑤中的操 作方法相同,但目的不同。在步骤②中的目是 ,在步骤⑤中的目的是 。
作方法相同,但目的不同。在步骤②中的目是 ,在步骤⑤中的目的是 。
(2)步骤③中加入的试剂是 (写化学式);步骤⑤中进行的“某一操作”是 ,目的是 。
(3)步骤⑥中你认为需要称量的固体A 还是固体B, (填A或B),你不选择另一种固体的理由是 。
还是固体B, (填A或B),你不选择另一种固体的理由是 。
“西气东输”是西部开发的重点工程,气体是指天然气,其主要成分是甲烷。工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2,两者的体积比约为1:1。已知1mol CO气体完全燃烧生成CO2气体放出283kJ热量,2molH2完全燃烧生成液态水放出572kJ热量;1molCH4气体完全燃烧生成CO2气体和液态水放出890kJ热量。
(1)写出H2燃烧热的热化学反应方程式:____________ _____________,若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出的热量________890kJ(填“>”、“=”或“<”)
(2)忽略水煤气中其它成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为________;燃烧生成的CO2的质量比约为________________。
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是:__________ 。
丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) ="=" 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) ="=" 6CO2(g) +6H2O(l)ΔH=-c kJ·mol-1
2H2(g)+O2 (g) ==2H2O(l)ΔH=-d kJ·mol-1(abcd均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径完全燃烧放出的热量,途径I放出的热量___ ___(填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量 (填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要 (填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________。
(3)b 与a、c、d的数学关系式是 。
(本题共14分)常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO、Cl-、NO、CO,阳离子可能是Ag+、NH、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定不含有的阳离子是_______;所含阴离子相同的两种盐的化学式是__________________。
(2)M的化学式为_________________________,M溶液显碱性的原因是_______________________(用离子方程式表示)。
(3)X和Z的溶液反应的离子方程式是_________________________________;N和氨水反应的离子方程式是____________________________________。
(4)若要检验Y中所含的阳离子,正确的实验方法是______________________。
(本题共14分)氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1)NA表示阿伏加德罗常数的数值。69g NO2和N2O4的混合气体中含有____NA个氧原子;2L 0.6 mol/LFe(NO3)3溶液中含_____NA个NO3-离子。
(2)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,
① 写出该反应的化学方程式 .若反应中生成0.15 mol HNO3,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F;据题意推测 NF3,F2,NO三种气体中,氧化性由强到弱的顺序为
③NF3是一种无色、无臭的气体,一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有__________________(填化学式).
(3)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
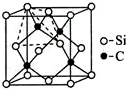
【物质结构与性质】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。回答下列问题:
(1)基态铜原子的电子排布式为 ;已知高温下CuO—→Cu2O+O2,试从铜原子价层电子结构变化角度解释这一反应发生的原因: 。
(2)硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ,若“Si-H”中键合电子偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为__ __。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3.NH3,BF3.NH3中B原子的杂化轨道类型为_______________,B与N之间形成 键。
(4)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示;则金刚砂晶体类型为 ,在SiC中,每个C原子周围最近的C原子数目为 ,若晶胞的边长为a pm,则金刚砂的密度为 。